题目内容
3. 反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | 增大压强,平衡向正反应方向移动 |
分析 根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动;温度一定时,增大压强,G的体积分数增大,平衡逆向移动,以此解答该题.
解答 解:根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动,升高温度平衡向吸热方向移动,所以正反应是吸热反应;
温度一定时,增大压强,G的体积分数增大,平衡逆向移动,增大压强平衡向气体体积减小的方向移动,所以a<b;
固体质量的多少不影响平衡移动,
故选B.
点评 本题考查化学平衡移动影响因素,为高频考点,侧重考查学生识图能力及知识综合应用能力,明确温度、压强对化学平衡移动影响原理是解本题关键,难度不大.

练习册系列答案
相关题目
13.工业合成氨的反应是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂.已知形成1 mol H-H键、1 mol N-H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ.则:
(1)写出工业合成氨的化学方程式N2(g)+3H2(g)?2NH3(g).
(2)若0.5mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量46kJ.
(3)如果将0.5mol N2和1.5mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ.
(4)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过5min后,数据如下,则用N2表示的化学反应速率为0.4mol/L/min.
(5)一定条件下,当合成氨的反应达到化学平衡时,下列说法不正确的是bde.
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度.
(1)写出工业合成氨的化学方程式N2(g)+3H2(g)?2NH3(g).
(2)若0.5mol N2完全反应生成NH3可放出(填“吸收”或“放出”)热量46kJ.
(3)如果将0.5mol N2和1.5mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是该反应是可逆反应,反应物不能完全转化为生成物,所以放出的热量要小于46kJ.
(4)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过5min后,数据如下,则用N2表示的化学反应速率为0.4mol/L/min.
| 物质 | N2 | H2 | NH3 |
| 反应前 | 16mol | xmol | 0 |
| 5min | ymol | 28mol | 8mol |
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度.
14.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)?CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如表:
a、b、c、d与m、n、x、y之间的关系式为.
已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
| v正 | v逆 | 平衡常数K | 转化率α |
| 增大 | 增大 | 减小 | 减小 |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
18.研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2 NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
| A. | 潮湿的氯气通过盛有浓H2SO4的洗气瓶 | |
| B. | 硫化氢通入浓H2SO4中 | |
| C. | 浓H2SO4滴入萤石中,加热 | |
| D. | 加入少量H2SO4使乙酸乙酯水解 |
8.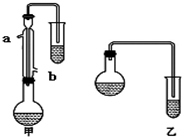 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
(1)甲和乙两位同学分别设计了如下图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(2)实验中浓硫酸的作用是催化剂、吸水剂.
(3)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称.
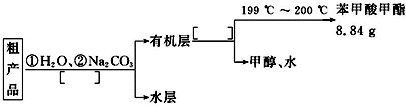
 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(2)实验中浓硫酸的作用是催化剂、吸水剂.
(3)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称.

12.下列反应中,熵显著增加的反应是( )
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
13.下列有关化学用语表示正确的是( )
| A. | 对烃基苯甲醛的结构简式: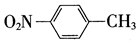 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: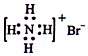 | D. | 二氧化碳分子的比例模型: |