题目内容
19.如表中对应关系错误的是( )| A | NaCl═Na++Cl NH3•H2O?NH4++OH- | 均属于电离方程式 |
| B | 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀 | 说明该溶液中一定有SO${\;}_{4}^{2-}$ |
| C | Ba2++SO${\;}_{4}^{2-}$═BaSO4↓; HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | 均可表示一类反应 |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钠为强电解质,完全电离,一水合氨为弱电解质,电离方程式用可逆号;
B.生成的白色沉淀可能为氯化银,原溶液中不一定含有硫酸根离子;
C.根据离子方程式的意义可知,题中两个离子方程式都可以表示一类反应;
D.根据氯气、S在两个反应中化合价变化进行判断.
解答 解:A.氯化钠的电离方程式为:NaCl═Na++Cl,氨水为弱碱,一水合氨的电离方程式为NH3•H2O?NH4++OH-,故A正确;
B. 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀,该白色沉淀可能为AgCl,原溶液中不一定含有SO42-,故B错误;
C.Ba2++SO42-═BaSO4↓可表示可溶性钡盐与硫酸盐反应生成硫酸钡沉淀和可溶性盐的一类反应,HCO3-+OH-═CO32-+H2O可表示可溶性碳酸氢盐与强碱溶液反应的一类反应,故C正确;
D.Cl2+2NaOH═NaCl+NaClO+H2O中的氯气在反应中Cl的化合价既升高又降低,3S+6NaOH═2Na2SO3+3H2O中S元素的化合价既有升高又有降低,所以氯气和S既作氧化剂又作还原剂,故D正确;
故选B.
点评 本题考查了离子方程式书写、氧化还原反应、离子检验等知识,题目难度中等,明确离子方程式的书写原则、常见离子的检验方法为解答关键,注意掌握氧化还原反应中氧化剂、还原剂的判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 向某无色溶液中滴加BaCl2溶液,出现白色沉淀,说明溶液中存在SO42- | |
| C. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
7.下列反应中必须加入还原剂才能进行的是( )
| A. | H2SO4→SO2 | B. | Zn2+→Zn | C. | H2O→H2 | D. | CuO→CuCl2 |
14.下列各组中的离子,能在无色透明的溶液中大量共存的是( )
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
11.短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍.X与Y、Z位于相邻的周期.下列说法正确的是( )
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
8.100mL三种盐的混合溶液中含有0.2mol Na+,0.25mol Mg2+,0.4mol Cl-,则SO42-浓度为( )
| A. | 1.5 mol•L-1 | B. | 1 mol•L-1 | C. | 0.15 mol•L-1 | D. | 3 mol•L-1 |
 B(OH)4-+H+;
B(OH)4-+H+;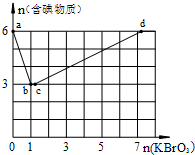 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.