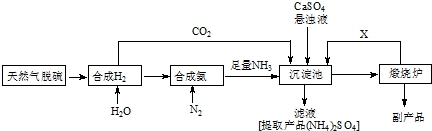
题目内容
7.在一定温度下,向某恒压的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡的标志是( )| A. | N2、H2和NH3三者共存 | |
| B. | 容器内气体的密度不再发生变化 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | 单位时间消耗0.1 mol N2的同时生成0.2 mol NH3 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、只要反应发生就是三者共存的体系,故A错误;
B、容器内气体的密度不再发生变化,说明气体的物质的量不变,达平衡状态,故B正确;
C、N2、H2和NH3的物质的量浓度不变,而不一定相等,故C错误;
D、单位时间消耗0.1 mol N2的同时生成0.2 mol NH3,都反映的是正反应方向,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
15.下列字母表示短周期中几种元素的位置,请回答下列问题.
(1)D2-的离子结构示意图为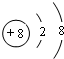 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为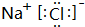 .
.
(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
| A | |||||||
| B | C | D | |||||
| E | F | G | H | I | |||
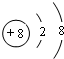 ,E与I形成的化合物的电子式为
,E与I形成的化合物的电子式为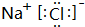 .
.(2)E,G,H三元素的最高价氧化物对应水化物的溶液间相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3+3H+=Al3++3H2O,OH-+H+=H2O.
(3)F和I形成的化合物中存在的化学键类型是离子键,在A~I九种元素中,完全由非金属元素形成的一个离子化合物的化学式是NH4NO3.
(4)4.8g单质F能与标准状况下2.24L的B的最高价氧化物恰好反应.
2.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图,下列说法正确的是( )
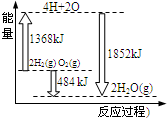

| A. | 该反应是吸热反应过程 | |
| B. | 由2molH2和1molO2变成4molH、2molO原子需要放出能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量 | |
| D. | 4molH、2molO生成2molH2O(g),共放出484kJ能量 |
12.某两种气态烃组成的混合物,取其2.24L(标准状况下)充分燃烧,得到0.16mol二氧化碳气体和3.6g液态水.据此判断下列分析中不正确的是( )
| A. | 此混合气体中可能含有乙烷 | |
| B. | 此气体中一定含有甲烷 | |
| C. | 此混合气体中一定不含有丙烷 | |
| D. | 此气体若是乙烯与甲烷的混合气体,则甲烷与乙烯的体积比为2:3 |
19.短周期元素H、X、Y、Z在周期表中的相对位置如图所示.已知X的最高正价和最低负价的代数和为0,下列推断正确的是( )
| X | Y | ||
| H | Z |
| A. | 常温下,含H的两种离子都能使水电离出的c•(H+)•c(OH-)增大 | |
| B. | Y的简单氢化物和Y的最高价含氧酸之间能发生氧化还原反应 | |
| C. | X的气态氢化物的热稳定性比Y的气态氢化物的热稳定性强 | |
| D. | 简单离子半径的大小顺序为H>Z>Y |