题目内容
1.某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程: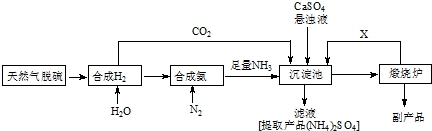
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:2NH4HS+O2$\frac{\underline{\;一定条件\;}}{\;}$ 2NH3•H2O+2S.
(2)沉淀池中反应的化学方程式为CaSO4+CO2+2NH3+H2O=CaCO3 +(NH4)2SO4
(3)在上述流程中可以循环使用的X是CO2(填化学式),从(NH4)2SO4溶液中获得(NH4)2SO4晶体操作的步骤是加热浓缩、冷却结晶、过滤、洗涤、干燥.
分析 (1)H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;
(2)将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3;
(3)CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;从溶液中获取晶体应采取蒸发浓缩、冷却结晶、过滤等操作.
解答 解:(1)H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,
依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2 $\frac{\underline{\;一定条件\;}}{\;}$ 2NH3•H2O+2S,
故答案为:2NH4HS+O2 $\frac{\underline{\;一定条件\;}}{\;}$ 2NH3•H2O+2S;
(2)将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3 +(NH4)2SO4;
(3)CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用; 从溶液中获取晶体应采取蒸发浓缩、冷却结晶、过滤等操作,
故答案为:CO2 ,冷却结晶.
点评 本题考查物质的制备实验方案的设计,题目难度中等,本题注意把握物质的性质,易错点为(2),注意根据反应物和生成物从质量守恒的角度书写反应的化学方程式.

练习册系列答案
相关题目
7.在一定温度下,向某恒压的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡的标志是( )
| A. | N2、H2和NH3三者共存 | |
| B. | 容器内气体的密度不再发生变化 | |
| C. | N2、H2和NH3的物质的量浓度相等 | |
| D. | 单位时间消耗0.1 mol N2的同时生成0.2 mol NH3 |
9.糖类与我们的日常生活息息相关.关于糖类物质的说法正确的是( )
| A. | 糖类均有甜味 | B. | 淀粉和纤维素均不是糖类 | ||
| C. | 糖类均不可水解 | D. | 糖类都含有C、H和O元素 |
6.已知锶的核电核数为38,其单质密度为2.50g/cm3,下列说法中一定错误的是( )
| A. | 颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈 | |
| B. | 锶在纯净氮气中可以燃烧,燃烧产物投入水中可以放出气体 | |
| C. | 锶在纯氧中点燃可燃烧,燃烧生产的产物投入水中可以放出气体 | |
| D. | 颗粒状的单质锶投入水中,剧烈反应,生成大量的气体并引起气体燃烧和轻微爆炸 |
13.下列说法不正确的( )
| A. | 互为同分异构体的物质化学性质不一定相似 | |
| B. | 等物质的量的烃A和烃B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值可能为16 | |
| C. | 如果烃中各元素的质量百分含量都相同,则它们必定是同分异构体 | |
| D. | 氰酸铵(NH4OCN)与尿素[CO(NH2)2]互为同分异构体 |
10.崇明县为“打造世界级生态岛,创建全国文明县城”而采取的下列措施与倡议中,能有效减少PM2.5的是( )
| A. | 垃圾回收 | B. | 绿色出行 | C. | 交通整顿 | D. | 河道整治 |
11.C+O2?2CO是一个可逆反应,下列关于该反应的说法中,正确的是( )
| A. | 该反应进行到一定程度时即停止 | |
| B. | 反应开始之初,正反应速率大于逆反应速率 | |
| C. | 若在密闭容器中反应,C和CO2能100%转化为CO | |
| D. | 使用碳粉和碳块,对该反应的速率无明显影响 |