题目内容
9.某化学学习小组探究下列实验(本题中两种溶液混合,总体积的变化忽略不计)①取20mL l mol/L的KOH溶液,滴加酚酞试液,溶液呈红色;
②向①中溶液内逐滴加入某浓度的H2SO4溶液,至10mL时,刚好完全反应,溶液无色;
③另取20mL l mol/L的KOH溶液,加入与②中同浓度的H2SO4溶液20mL;
④蒸发结晶③中所得溶液,得到白色固体甲;
⑤将④中所得固体甲完全溶于水,加入0.1mol/L Ba(OH)2溶液至沉淀不再增加为止.
根据以上信息,请回答下列问题:
(1)所用H2SO4溶液的物质的量浓度是1mol/L;
(2)③中所得溶液里阴离子的物质的量浓度是0.5mol/L;
(3)⑤中得到最大沉淀量时反应的离子方程式是Ba2++SO42-=BaSO4↓;
(4)加入的Ba(OH)2溶液的体积是200mL.
分析 (1)向①中溶液内逐滴加入某浓度的H2SO4溶液,至10mL时,刚好完全反应,溶液无色,说明碱中氢氧根离子物质的量等于酸中氢离子物质的量,即KOH和稀硫酸的物质的量比为2:1,据此计算硫酸物质的量浓度;
(2)先确定混合溶液中溶质及其浓度,再结合原子守恒计算;
(3)硫酸钾、硫酸和氢氧化钡反应生成硫酸钡、KOH和水,生成沉淀最大时发生钡离子和硫酸根离子的反应;
(4)钡离子和硫酸根离子以1:1进行反应,根据硫酸根物质的量计算氢氧化钡溶液体积.
解答 解:(1)向①中溶液内逐滴加入某浓度的H2SO4溶液,至10mL时,刚好完全反应,溶液无色,说明碱中氢氧根离子物质的量等于酸中氢离子物质的量,则n(KOH):n(H2SO4)=2:1,c(H2SO4)=$\frac{\frac{1mol/L×0.02L}{2}×1}{0.01L}$=1mol/L,故答案为:1mol/L;
(2)另取20mL l mol/L的KOH溶液,加入与②中同浓度的H2SO4溶液20mL,KOH和硫酸浓度相等体积相等,则二者物质的量相等,因为硫酸是二元酸,KOH是一元碱,所以稀硫酸有剩余,溶液中溶质为硫酸和硫酸钾且二者物质的量浓度相等,则溶液中c(SO42- )=$\frac{1mol/L×0.02L}{(0.02+0.02)L}$=0.5mol/L,
答:故答案为:0.5mol/L;
(3)硫酸钾、硫酸和氢氧化钡反应生成硫酸钡、KOH和水,生成沉淀最大时发生钡离子和硫酸根离子的反应,离子方程式为Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓;
(4)钡离子和硫酸根离子以1:1进行反应,V[Ba(OH)2]=$\frac{1mol/L×0.02L}{0.1mol/L}$=0.2V=200mL,
故答案为:200mL.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查分析计算能力,明确各个物质之间关系式是解本题关键,易错点是(3)题离子方程式的书写,开始时生成硫酸钡还生成水,当氢离子完全反应后,就只有生成硫酸钡的反应,题目难度不大.

| A. | 碳酸钙与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| C. | 碳酸氢钠溶液与硫酸氢钠溶液反应 HCO3-+H+═CO2↑+H2O | |
| D. | 铝片插入硝酸汞溶液中:Al+Hg2+═Al3++Hg |
| A. | 熔融氢氧化钠 | B. | 石墨棒 | C. | 盐酸溶液 | D. | 固态氢氧化钾 |
| A. | 亚硫酸是SO2与水反应的产物,显酸性 | |
| B. | SO2溶于水,剧烈反应生成亚硫酸 | |
| C. | 亚硫酸具有漂白性,能够使品红溶液褪色 | |
| D. | 亚硫酸不稳定,容易分解为水和SO2 |
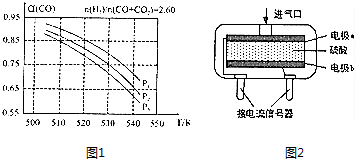 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下:
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醛,主要反应如下: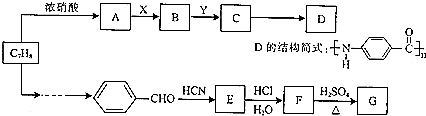
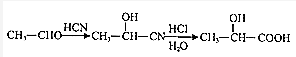
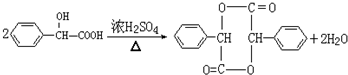 .
.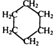 可用键线式表示为
可用键线式表示为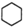 ,
,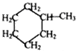 可用键线式表示为
可用键线式表示为 ;
;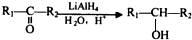 ;
;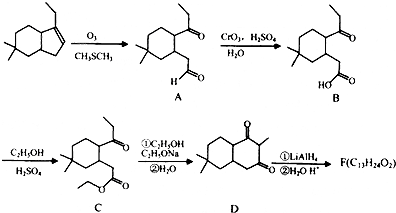
 ;
; ;
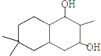
;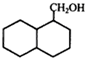 结构
结构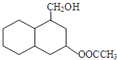 .
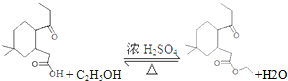
.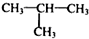 制
制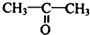 的流程图并注明反应条件.
的流程图并注明反应条件.