题目内容
20.煤的干馏产物甲苯通过下列转化可以合成一种聚酰胺类高分子化合物D,以及另一含三个六元环的酯类化合物G.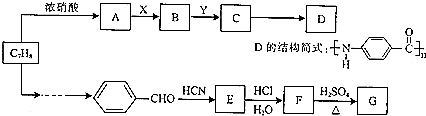
已知:
Ⅰ.C6H5-NH2$\stackrel{[O]}{→}$焦油状的负杂物质;C6H5-NO2$\stackrel{Fe,HCl}{→}$C6H5-NH2
Ⅱ.
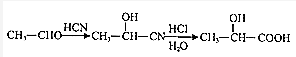
请回答:
(1)A中官能团的名称是硝基.
(2)C→D的反应类型为缩聚反应.
(3)写出F→G的化学方程式
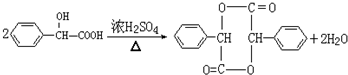 .
.(4)X是下列试剂中的一种,其中X是②(填编号),选择的理由是防止氨基被氧化.
①Fe和HCl ②KMnO4酸性溶液.
分析 由D的结构简式可知,C发生缩聚反应生成D,故C为 ,甲苯发生硝化反应生成A,A经过系列反应得到C,可知A为
,甲苯发生硝化反应生成A,A经过系列反应得到C,可知A为 ,由于氨基易被氧化,故应先将甲基氧化为羧基,再将硝基还原为氨基,故X可以是酸性高锰酸钾溶液,Y为Fe/HCl,则B为
,由于氨基易被氧化,故应先将甲基氧化为羧基,再将硝基还原为氨基,故X可以是酸性高锰酸钾溶液,Y为Fe/HCl,则B为 ;
;
甲苯通过一系列反应生成苯甲醛,苯甲醛和HCN发生信息II的反应生成E,E结构简式为 ,E发生水解反应生成F为
,E发生水解反应生成F为 ,F在浓硫酸作用生成含三个六元环的酯类化合物G,应是2分子F发生酯化反应生成环酯,则G为
,F在浓硫酸作用生成含三个六元环的酯类化合物G,应是2分子F发生酯化反应生成环酯,则G为 ,据此分析解答.
,据此分析解答.
解答 解:由D的结构简式可知,C发生缩聚反应生成D,故C为 ,甲苯发生硝化反应生成A,A经过系列反应得到C,可知A为
,甲苯发生硝化反应生成A,A经过系列反应得到C,可知A为 ,由于氨基易被氧化,故应先将甲基氧化为羧基,再将硝基还原为氨基,故X可以是酸性高锰酸钾溶液,Y为Fe/HCl,则B为
,由于氨基易被氧化,故应先将甲基氧化为羧基,再将硝基还原为氨基,故X可以是酸性高锰酸钾溶液,Y为Fe/HCl,则B为 ;
;
甲苯通过一系列反应生成苯甲醛,苯甲醛和HCN发生信息II的反应生成E,E结构简式为 ,E发生水解反应生成F为
,E发生水解反应生成F为 ,F在浓硫酸作用生成含三个六元环的酯类化合物G,应是2分子F发生酯化反应生成环酯,则G为
,F在浓硫酸作用生成含三个六元环的酯类化合物G,应是2分子F发生酯化反应生成环酯,则G为 ,
,
(1)A为 ,A中官能团的名称是硝基,故答案为:硝基;
,A中官能团的名称是硝基,故答案为:硝基;
(2)C发生缩聚反应生成D,所以C→D的反应类型为缩聚反应,故答案为:缩聚反应;
(3)F→G的化学方程式为 ,故答案为:
,故答案为: ;
;
(4)X是酸性高锰酸钾溶液,是为了防止氨基被氧化,故答案为:②;防止氨基被氧化.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断及知识迁移、知识综合应用能力,根据生成物、反应物、反应条件及题给信息采用正逆结合的方法进行推断,注意题给信息的正确运用,题目难度中等.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 马口铁镀锡的表面即使破损后也能起到很好的防锈作用 | |
| B. | FeCl3饱和溶液滴入到沸水中,并继续煮沸,可得到Fe(OH)3沉淀 | |
| C. | 反应AgCl+NaBr═AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水 | |
| D. | 除去某溶液中的SO42-,选择加入可溶性钡盐要比加入钙盐好 |
8.下列有关化学用语正确的是( )
| A. | 比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl |
15.下列实验方案或实验操作中,不能达到实验目的是( )
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
5.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 蒸馏时应先向冷凝管中通入冷凝水再加热 |
2.在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)?3C(g),平衡时A的浓度为0.60mol/L,保持温度不变,将容器体积压缩到原来的$\frac{1}{2}$,再次达到平衡时,测得A的浓度为1mol/L,下列有关判断正确的是( )
| A. | x+y>3 | |
| B. | 反应速率加快,活化分子百分数增加 | |
| C. | A的转化率减小,体积分数增大 | |
| D. | 平衡正向移动,平衡常数增大 |