题目内容
11.如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氯化亚铁溶液)、C(碘化钾淀粉溶液)、D(紫色石蕊试液)、F(含酚酞的氢氧化钠溶液).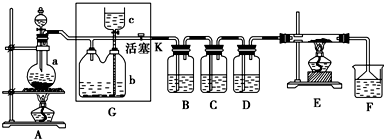
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)G中b瓶内宜加入的液体是饱和食盐水
(3)实验开始后B中反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,
(4)C中的现象是溶液变蓝
(5)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl.
(6)F中发生氧化还原反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)二氧化锰与浓盐酸加热生成氯化锰和氯气、水;
(2)G中b瓶是用来贮存Cl2的,则应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水;
(3)氯气具有强的氧化性,能够氧化二价铁离子生成三价铁离子;
(4)氯气与碘化钾反应生成单质碘,碘遇到淀粉变蓝;
(5)依据题意可知氯气与碳、水蒸气反应生成二氧化碳和氯化氢,依据原子个数守恒、得失电子守恒书写方程式;
(6)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水.
解答 解:(1)二氧化锰与浓盐酸加热生成氯化锰和氯气、水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)G中b瓶是用来贮存Cl2的,则应选用一种Cl2在其中溶解度非常小的液体,一般选用饱和食盐水;
故答案为:饱和食盐水;
(3)氯气与氯化亚铁反应生成氯化铁,离子方程式:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)氯气与碘化钾反应生成单质碘,碘遇到淀粉变蓝,所以能够看到溶液变蓝;
故答案为:溶液变蓝;
(5)依据题意可知氯气与碳、水蒸气反应生成二氧化碳和氯化氢,依据原子个数守恒、得失电子守恒,反应的化学方程式:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl;
故答案为:2Cl2+C+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl;
(6)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题综合考查了氯气的制法、性质、化学实验操作及实验装置等问题,把握氯气的性质以及相关实验操作方法是解题关键,题目难度不大.

 走进文言文系列答案
走进文言文系列答案| A. | x+y>3 | |
| B. | 反应速率加快,活化分子百分数增加 | |
| C. | A的转化率减小,体积分数增大 | |
| D. | 平衡正向移动,平衡常数增大 |
| A. | 13C与15N具有相同的中子数 | |
| B. | 0.012kg 13C所含的碳原子数为阿伏加德罗常数 | |
| C. | 等物质的量的13C17O和15N2,两气体具有相同的质子数、原子数和质量 | |
| D. | 13C、15N和C60、N70互为同位素 |
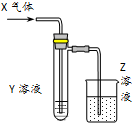 用以如图示装置研究物质的性质,能够获得可靠结论的是( )
用以如图示装置研究物质的性质,能够获得可靠结论的是( )| X | Y | Z | 结论 | |
| A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
| B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
| C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
| D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA | |
| B. | 1L0.1 mol•L-1 Na2CO3溶液中含有CO32-数为0.1 NA | |
| C. | 常温常压下,18g水含有的分子数为 NA | |
| D. | 常温下,1mol Cl2与过量NaOH溶液反应,转移电子总数为2NA |
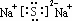 ;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
;其水溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).