题目内容
实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3.
(1)这六种物质中,反应物是 ;被还原的元素是 .
(2)若该反应是恰好完全反应,且收集到NO的体积为4.48L(标况时),测得反应后溶液的体积为250mL.
反应过程中转移的电子数为 ;所得溶液中SO42-的物质的量浓度为 mol?L-1.
(1)这六种物质中,反应物是
(2)若该反应是恰好完全反应,且收集到NO的体积为4.48L(标况时),测得反应后溶液的体积为250mL.
反应过程中转移的电子数为
考点:氧化还原反应的计算,氧化还原反应
专题:
分析:根据氧化还原反应的基本规律,HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,则反应中FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,结合元素的化合价变化计算转移电子,以此来解答.
解答:
解:氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价升高的为Fe,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,该反应为4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O,
(1)由上述分析可知,反应物为FeSO4、HNO3,生成物为Fe(NO3)3、Fe(SO4)3、NO、H2O,被还原的元素为N元素,故答案为:FeSO4、HNO3;N;
(2)收集到NO的体积为4.48L(标况时),n(NO)=
=0.2mol,反应中N元素化合价由+5价降低到+2价,则转移电子的物质的量为0.2mol×3=0.6mol,
个数为0.6mol×6.02×1023/mol=3.6×1023,
由方程式可知生成n(SO42-)=0.2mol×3=0.6mol,
c(SO42-)=
=2.4L/mol,
故答案为:3.6×1023;2.4.
(1)由上述分析可知,反应物为FeSO4、HNO3,生成物为Fe(NO3)3、Fe(SO4)3、NO、H2O,被还原的元素为N元素,故答案为:FeSO4、HNO3;N;
(2)收集到NO的体积为4.48L(标况时),n(NO)=
| 4.48L |
| 22.4L/mol |
个数为0.6mol×6.02×1023/mol=3.6×1023,
由方程式可知生成n(SO42-)=0.2mol×3=0.6mol,
c(SO42-)=
| 0.6mol |
| 0.25L |
故答案为:3.6×1023;2.4.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化是解答本题的关键,注意硝酸的强氧化性及从化合价角度分析解答,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列有关氧化还原反应说法正确的是( )
| A、工业制硫酸、工业制硝酸、由石英获取单晶硅变化均为氧化还原反应 |
| B、氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触 |
| C、置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应 |
| D、氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列属于3区域的是( )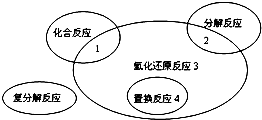

| A、Fe+CuSO4=FeSO4+Cu | ||||
B、2KMnO4
| ||||
| C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
| D、2Na2O2+2CO2=2Na2CO3+O2 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| B、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
| D、金属的电化学腐蚀普遍存在,工业上经常用牺牲阳极的阴极保护法对金属进行保护,这是电解原理的一个重要应用 |
下列反应中属于放热反应的是( )
| A、电解Al2O3得到Al和O2 |
| B、石灰石高温分解为生石灰和二氧化碳 |
| C、铝粉与氧化铁高温反应 |
| D、Ba(OH)2?8H2O和NH4Cl晶体混合反应 |
水是生命之源.下列关于水的说法正确的是( )
| A、水属于非电解质 |
| B、氢氧两种元素只能组成水 |
| C、0℃时冰的密度比液态水的密度大 |
| D、标准状况下,18g水分子的物质的量为1mol |