题目内容
6.乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛热.合成原理是: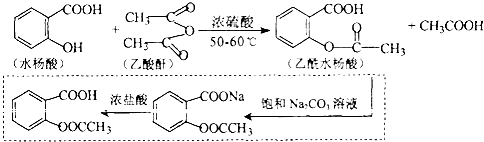
(1)水杨酸中含氧官能团的名称是羟基、羧基,有关水杨酸的说法,正确的是AD.
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和水解反应
C.能与溴水发生取代反应和加成反应
D.1mol水杨酸最多能与3molH2发生加成反应
(2)水杨酸与乙酸酐反应的反应类型是取代反应.
(3)乙酰水杨酸的分子式为C9H8O4,1mol乙酰水杨酸最多能与3mol NaOH反应.
(4)虚框中为提纯,是为了除去该反应的副产物:水杨酸、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等,请写出乙酰水杨酸粗品中加入饱和Na2CO3溶液发生的主要化学反应方程式为:

(5)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式:

Ⅰ.能遇FeCl3溶液显紫色Ⅱ.苯环上只有一种一溴取代物
Ⅲ.能发生银镜反应
Ⅳ.1mol该化合物能分别与1mol NaOH和2mol金属钠反应
(6)
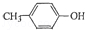 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.
分析 (1)水杨酸中含酚-OH、-COOH,结合酚及羧酸的性质分析;
(2)由合成反应可知,酚-OH上的H被取代;
(3)由结构简式可知分子式,乙酰水杨酸中-COOH、-COOC-及-COOC-水解生成的酚-OH均与NaOH反应;
(4)乙酰水杨酸粗品中加入饱和Na2CO3溶液,-COOH与碳酸钠反应;
(5)乙酰水杨酸的同分异构体符合:
Ⅰ.能遇FeCl3溶液显紫色,则含酚-OH;
Ⅱ.苯环上只有一种一溴取代物,则苯环上只有1种H;
Ⅲ.能发生银镜反应,含-CHO;
Ⅳ.1mol该化合物能分别与1molNaOH和2mol金属钠反应,则含1个酚-OH,1个醇-OH;
(6) 也能与乙酸酐发生类似反应,为取代反应.
也能与乙酸酐发生类似反应,为取代反应.
解答 解:(1)水杨酸中含酚-OH、-COOH,名称分别为羟基、羧基,则
A.含酚-OH,遇 FeCl3溶液可能显紫色,故A正确;
B.含-OH、-COOH,可发生酯化反应,但不能发生水解反应,故B错误;
C.含酚-OH,能与溴水发生取代反应,但不能发生加成反应,故C错误;
D.只有苯环与氢气发生加成反应,则1mol水杨酸最多能与3molH2发生加成反应,故D正确;
故答案为:羟基、羧基;AD;
(2)由合成反应可知,酚-OH上的H被取代,该反应为取代反应,故答案为:取代反应;
(3)由结构简式可知分子式为C9H8O4,乙酰水杨酸中-COOH、-COOC-及-COOC-水解生成的酚-OH均与NaOH反应,则1mol乙酰水杨酸最多能与3molNaOH反应,
故答案为:C9H8O4;3;
(4)乙酰水杨酸粗品中加入饱和Na2CO3溶液,-COOH与碳酸钠反应,反应为 ,
,
故答案为: ;
;
(5)乙酰水杨酸的同分异构体符合:
Ⅰ.能遇FeCl3溶液显紫色,则含酚-OH;
Ⅱ.苯环上只有一种一溴取代物,则苯环上只有1种H;
Ⅲ.能发生银镜反应,含-CHO;
Ⅳ.1mol该化合物能分别与1molNaOH和2mol金属钠反应,则含1个酚-OH,1个醇-OH,则符合条件的结构简式为 ,
,
故答案为: ;
;
(6) 也能与乙酸酐发生类似反应,为取代反应,反应为
也能与乙酸酐发生类似反应,为取代反应,反应为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握有机物的官能团与性质、结构与性质的关系为解答的关键,侧重分析与应用能力、推断能力的考查,题目难度中等.

| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |


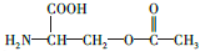 .
. b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成 .
.
 .
.