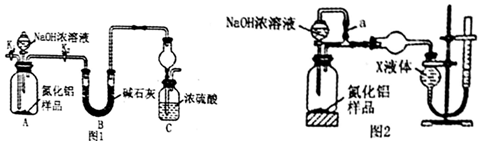
题目内容
11.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(主要成分是FeS2)是生产硫酸和冶炼钢铁的重要原料.
反应I:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+6SO2
反应II:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
若反应I和反应II中FeS2的量相等,则电子转移数之比为32:33.
(2)淀粉KI试纸可以检测硫酸亚铁溶液是否变质,写出反应的离子方程式:2Fe3++2I-=2Fe2++I2.
(3)用氯化铁溶液腐蚀印刷电路板,在废液中加入适量铁粉,过滤.在滤渣中加入稀盐酸,产生气泡,则滤液中的金属离子主要是Fe2+.
(4)取一定量磁性氧化铁溶于200ml、5mol/L盐酸中,再加入一定量铁粉,恰好完全溶解,收集到2.24L(标准状况)气体.经检测.反应后的溶液不能使KSCN溶液变红色,则参加反应的铁粉的质量是11.2g.
分析 (1)由于反应I和反应II中FeS2的量相等,所以可设FeS2的物质的量为12mol,所以反应Ⅰ中转移电子的物质的量为32×4mol,反应Ⅱ转移电子的物质的量为33×4mol;
(2)如果亚铁变质生成铁离子与碘离子反应生成紫黑色固体碘,由此书写离子反应方程;
(3)用氯化铁溶液腐蚀印刷电路板,生成氯化亚铁和氯化铜,而在滤渣中加入稀盐酸,产生气泡,说明氯化铁与铁反应,铁过量,所以铜离子反应完全;
(4)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)由于反应I和反应II中FeS2的量相等,所以可设FeS2的物质的量为12mol,所以反应Ⅰ中转移电子的物质的量为32×4mol,反应Ⅱ转移电子的物质的量为33×4mol,故答案为:32:33;
(2)如果亚铁变质生成铁离子与碘离子反应生成紫黑色固体碘,所以离子反应方程2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(3)用氯化铁溶液腐蚀印刷电路板,生成氯化亚铁和氯化铜,而在滤渣中加入稀盐酸,产生气泡,说明氯化铁与铁反应,铁过量,所以铜离子反应完全,最后滤液中的金属离子主要是Fe2+,故答案为:Fe2+;
(4)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
反应后的溶液不能使KSCN溶液变红色,所以所得溶液为氯化亚铁溶液,根据氯原子守恒,反应溶液中氯化铁的物质的量为$\frac{1}{2}$×0.2L×5mol/L=0.5mol,由氢守恒可知四氧化三铁的物的量为:$\frac{1-0.1×2}{8}$=0.1mol:与盐酸反应生成氯化铁的物质的量为0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
点评 本题考查了金属单质及其化合物性质的综合应用、离子方程式的书写及有关方程式的计算,题目难度中等,明确金属单质及其化合物的物质的性质及发生的反应是解题关键,试题培养了学生的分析能力及化学计算能力.

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用100 mL容量瓶配制90mL1mol/L的NaOH溶液 | |
| C. | 用量筒量取5.65mL的浓硫酸 | |
| D. | 用托盘天平准确称取3.2gNaCl固体 |
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 盐酸 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品.(一)制备α-氯乙基苯的反应如下:
 +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
(2)图中能正确反映平衡常数K随温度变化关系的曲线为b(填曲线标记字母),其判断理由是该反应正方向放热,升高温度使平衡正向移动,平衡常数增大.
(二)催化脱氢生产苯乙烯的反应如下:
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol(3)气相反应的化学平衡常数有多种表示方法,可用各气体物质的量分数代替浓度项表示平衡常数,写出上述反应的平衡常数表达式Kχ=$\frac{λ(氢气)•λ(苯乙烯)}{λ(乙苯)}$.(用符号χ表示气体物质的量分数).
(4)工业上,在恒压条件下进行上述反应时,将乙苯与水蒸气的混合气体通入反应器中(已知水蒸气不参与反应),加入水蒸气可以使乙苯的转化率增大,用化学平衡理论解释乙苯转化率增加的原因恒压条件下加入水蒸气,体积增大,使反应体系减压,平衡正向移动.