题目内容
16.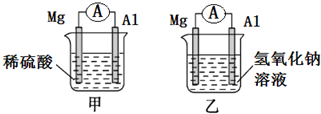 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.请回答:
(1)写出甲池中正极的电极反应式:2H++2e-=H2↑.
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:Al+4OH--3e-=AlO2-+2H2O;
总反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出Mg 活动性更强,而乙会判断出Al活动性更强(填写元素符号).
(4)由此实验,可得到如下哪些正确结论?ad(填写字母序号).
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是“不可靠”的.
分析 (1)甲同学将电极放入2mol/L H2SO4溶液中,镁比铝活泼,甲池中正极发生还原反应,电极反应式:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析.
解答 解:(1)甲同学将电极放入2mol/L H2SO4溶液中,镁比铝活泼,甲池中正极发生还原反应,电极反应式:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)a.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
b.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
c.该实验对研究物质的性质有实用价值,故错误;
d.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故答案为:ad.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.

Ⅰ.氯化铜的制备
该研究性小组在实验室里用如表仪器和药品来制取纯净的无水氯化铜:
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  |  |  |  |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号,用①、②等序号填写):③接⑤接④接②接①接⑥.
(2)装置④的作用是除去氯气中混杂的氯化氢气体;
(3)在装置⑤的烧瓶中,发生反应的化学方程式为4NaCl+4H2SO4(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+4NaHSO4+Cl2↑+2H2O
Ⅱ.探究Cu(OH)2是否和Al(OH)3一样具有两性
(4)该研究性学习小组取适量实验Ⅰ中制得的产品氯化铜固体充分溶解在一定浓度的盐酸中,过滤,得氯化铜溶液;为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择配制的氯化铜溶液外,还需要一定选用的试剂为bc (填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
Ⅲ.探究不同价态铜的稳定性
(5)该研究性学习小组用实验Ⅱ中所获得的氢氧化铜沉淀制得氧化铜粉末,然后将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更稳定 (填“稳定”或“不稳定”).
(6)向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为Cu2O+2H+=H2O+Cu2++Cu.
| A. | 108:1:108 | B. | 1:1:108 | C. | 1:108:1 | D. | 1:108:108 |
| A. | AB2分子的空间构型为V形 | |
| B. | AB2与H2O相比,AB2的熔、沸点比H2O的低 | |
| C. | AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 | |
| D. | A-B键为极性共价键,AB2分子为非极性分子 |
| A. | 由乙烯生成乙醇属于加成反应 | B. | 2-甲基丁烷也称异丁烷 | ||
| C. | 油脂和蛋白质都属于高分子化合物 | D. | C4H9Cl有3种同分异构体 |
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 |
| A. | 实验室用氯化铵和熟石灰制氨气:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜与浓硫酸反应:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| A. | 10种 | B. | 11种 | C. | 12种 | D. | 13种 |