题目内容
6.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室从海藻中提取碘的流程如下:海藻$\stackrel{晒干灼烧}{→}$海藻灰$\stackrel{浸泡}{→}$海藻灰悬浊液$\stackrel{①}{→}$
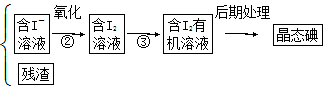
(1)写出提取碘的过程中有关实验操作的名称:①过滤;③萃取.
(2)提取碘的过程中可供选择的有机溶剂是B
A.汽油、酒精 B.四氯化碳、汽油 C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是漏斗、分液漏斗.
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图所示的实验装置中的错误之处:①温度计插入的位置错误,②冷却水的流向错误,③缺少沸石,④缺少石棉网
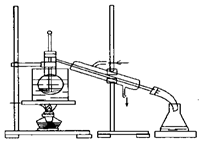
(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在蒸馏烧瓶里聚集.
分析 根据题意可知,海藻灰中含有碘离子,经过滤可得含有碘离子的溶液,选取适当的氧化剂将碘离子氧化为单质碘,将碘水中的碘用萃取剂萃取就得到碘的有机溶剂溶液,经过水浴蒸馏就可得到碘单质.根据这一条主线,可逐步回答问题.
(1)分离固体和液体用过滤;用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来用萃取;
(2)萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
(3)操作①是过滤,操作③是萃取分液,据此选择仪器;
(4)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,烧杯不能直接加热;混合溶液加热需要加入沸石防止暴沸
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏,为便于控制蒸馏时的温度,操作时使用水浴加热,晶体碘在蒸馏烧瓶中.
解答 解:(1)分离固体和液体用过滤,利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,
故答案为:过滤;萃取;
(2)萃取剂必须具备下列条件:碘在萃取剂中的溶解度大于在水中的溶解度,萃取剂和水不互溶,且萃取剂和碘不反应,四氯化碳和汽油符合条件;酒精和醋酸能互溶,不能做萃取剂,故选B,
故答案为:B;
(3)操作①是过滤,需要的仪器有漏斗、烧杯、玻璃棒、铁架台,操作③是萃取分液,乣的仪器是分液漏斗,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是漏斗、分液漏斗,
故答案为:漏斗、分液漏斗;
(4)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,烧杯不能直接加热,烧瓶中缺少沸石,
故答案为:温度计水银球的位置;冷却水的流向错误;缺少沸石;未垫石棉网;
(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在蒸馏烧瓶,故答案为:蒸馏烧瓶.
点评 本题考查物质的分离和提纯,学习中注意掌握过滤、萃取、蒸馏等操作,属于实验综合知识的考查,难度中等.

| A. | B. | C. | D. |
 |  |  |  |
| 用浸泡过KMnO4溶液的纸张保鲜水果 | 食用油中添加 TBHQ(一种酚类物质) | 红酒中添加 一定量的SO2 | 食品包装袋中 放置还原铁粉 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3g ${\;}_{1}^{3}$H发生核反应:${\;}_{1}^{2}H$+${\;}_{1}^{3}H$→${\;}_{2}^{4}He$+${\;}_{0}^{1}n$,净产生的中子数为NA | |
| B. | 0.1L1mol/L盐酸含有的H+的数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有的原子数目为5 NA | |
| D. | 1L0.4mol/L浓盐酸与足量的MnO2反应转移电子的物质的量为0.2 NA |
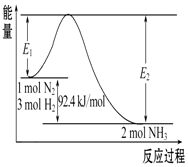 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
| A. | 等于20% | B. | 大于20% | C. | 小于20% | D. | 无法计算 |
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-a kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-b kJ/mol
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H3=-c kJ/mol
试计算2CO(g)+4H2(g)═H2O(l)+C2H5OH(l)的△H=-(2a+4b-c)kJ/mol.
(2)对反应N2O4(g)?2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法 不正确的是BC.
A.A、C两点的反应速率:A<C
B.B、C两点的气体的平均相对分子质量:B>C
C.A、C两点气体的颜色:A深,C浅
D.由状态A到状态B,可以用降温的方法
(3)在100℃时,将0.50mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
②该温度下,反应的平衡常数K值为2.2.(保留一位小数)
(4)甲醇-空气的燃料电池(电解质为KOH溶液)得到广泛应用,请写出该燃料电池负极的电极反应式CH3OH+8OH--6e-=CO32-+6H2O,若通入空气之前电解质KOH溶液的浓度为0.6mol/L,体积为100mL,当电子转移0.15mol后电解质溶液的pH为13.(体积保持不变,室温条件)
(5)电离度指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数的百分数.若室温下,c mol/L氨水的电离平衡常数为Kb,则该氨水的电离度 α=$\sqrt{\frac{{K}_{b}}{c}}$.(请用c和Kb表示,可进行近似计算)
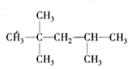
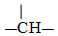 、
、 等结合而成的.试写出同时满足下列条件的烷烃的结构简式:
等结合而成的.试写出同时满足下列条件的烷烃的结构简式: