题目内容
6.25℃时,有关物质的电离平衡常数如下:| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
(4)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是①>②=③(填序号).
(5)已知,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
分析 (1)平衡常数等于电离出离子浓度乘积除以分子平衡浓度得到,常温下测得NaHSO3溶液的pH<7,说明HSO3-电离大于其水解溶液显酸性;
(2)酸性越弱,稀释后溶液的pH变化越大;
(3)酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱;
(4)c(H+)相同的盐酸和硫酸中和碱的能力相同,而盐酸和醋酸,因为醋酸是弱电解质,所以醋酸中和碱的能力强;
(5)利用盖斯定律计算反应热,标注聚集状态和焓变得到.
解答 解:(1)CH3COOH溶液中,电离平衡CH3COOH?CH3COO-+H+,平衡常数K=$\frac{{c({H^+})•c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$,常温下测得NaHSO3溶液的pH<7,其原因是HSO3-的电离程度大于其水解程度,
故答案为:$\frac{{c({H^+})•c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$;HSO3-的电离程度大于其水解程度;
(2)由于醋酸的酸性需小于亚硫酸,pH相同的醋酸和亚硫酸稀释相同倍数后,亚硫酸的pH变化大,即:醋酸的pH小于亚硫酸,
故答案为:<;
(3)已知酸性:H2SO3>CH3COOH>H2CO3>HSO3->HCO3-,酸根离子对应酸的酸性越强,该酸根离子结合氢离子能力越弱,则CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为:CO32->SO32->CH3COO->HSO3-,
故答案为:CO32->SO32->CH3COO->HSO3-;
(4)c(H+)相同的盐酸和硫酸中和碱的能力相同,而盐酸和醋酸,因为醋酸是弱电解质,所以醋酸中和碱的能力强,所以消耗NaOH溶液的体积由大到小的排列顺序为:①>②=③,
故答案为:①>②=③;
(5)实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则热化学方程式为:CH3COOH(aq)+OH-(aq)=H2O(l)+CH3COO-(aq)△H=-57.0kJ/mol…①;而H+(aq)+OH-(aq)=H2O(l)△H1=-57.3kJ/mol…②;由盖斯定律①-②得CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol,
故答案为:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol
点评 本题考查了弱电解质在溶液中的电离平衡、离子浓度比较、电离平衡常数计算、热化学方程式书写,题目难度中等,明确弱电解质的电离平衡的影响因素为解答关键,注意掌握判断电解质强弱、电离度的概念及计算方法,试题培养了学生的灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 苯(苯酚) | NaOH溶液 | 过滤 |
| C | 乙醇(乙酸) | CaO | 蒸馏 |
| D | 乙烷(乙烯) | 溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
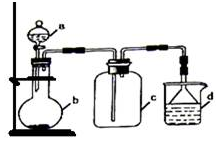 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 降低温度 | |
| B. | 保持容器的体积不变,增加A(g)的物质的量 | |
| C. | 保持容器的压强不变,充入氦气 | |
| D. | 保持容器的体积不变,充入氦气 |
| A. | 标准状况下,22.4 L CO和C2H4混合气体的总分子数为2NA,质量为28 g | |
| B. | 常温常压下,1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 1 L 0.1 mol/L (NH4)2SO4溶液中含NH4+离子数为0.2NA | |
| D. | 用惰性电极电解饱和食盐水,当两极共收集到气体4.48L时,外电路中转移电子数为0.2NA |
| A. | 同质量、不同密度的N2和CO | B. | 同温度、同体积的N2和H2 | ||
| C. | 同体积、同密度的C2H4和CH4 | D. | 同压强、同体积的N2O和CO2 |
| A. | 均为100mL0.1mol/L的两种溶液可中和等物质的量的氢氧化钠 | |
| B. | pH=3的两种溶液稀释100倍,pH都为5 | |
| C. | 相同浓度的两种溶液中c(H+)相同 | |
| D. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 |
| A. | N、O、F最高正价依次升高 | |
| B. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | Al3+、Na+、O2-微粒半径依次增大 |