题目内容
1.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,22.4 L CO和C2H4混合气体的总分子数为2NA,质量为28 g | |
| B. | 常温常压下,1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 1 L 0.1 mol/L (NH4)2SO4溶液中含NH4+离子数为0.2NA | |
| D. | 用惰性电极电解饱和食盐水,当两极共收集到气体4.48L时,外电路中转移电子数为0.2NA |
分析 A、求出混合物的物质的量,然后根据分子个数N=nNA来计算;
B、甲基中含9个电子;
C、铵根离子是弱碱阳离子,在溶液中会水解;
D、气体所处的状态不明确.
解答 解:A、标况下22.4L混合物的物质的量为1mol,故分子个数N=nNA=NA个,而CO和乙烯的摩尔质量均为28g/mol,故1mol混合物的质量为28g,故A错误;
B、甲基中含9个电子,故1mol甲基中含9NA个电子,故B正确;
C、铵根离子是弱碱阳离子,在溶液中会水解,故溶液中的铵根离子的个数小于0.2NA个,故C错误;
D、气体所处的状态不明确,故气体的物质的量无法计算,则电路中转移的电子数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某有机物的结构简式如图所示,下列关于该有机物的性质说法错误的是( )
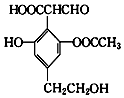

| A. | 该物质可以使酸性KMnO4溶液褪色,也可发生消去反应 | |
| B. | 该物质可与H2反应,1mol该物质最多消耗5mol H2 | |
| C. | 可以与FeCl3溶液反应显色,也可与Ag(NH3)2OH反应 | |
| D. | 可以与NaHCO3溶液反应放出CO2气体 |
16.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号)
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
| ①Zn为正极,Cu为负极 ②H+向负极移动 ③Cu极有H2产生 ④电子流动方向Zn→Cu ⑤正极的电极反应式是Zn-2e-=Zn2+ ⑥若有1mol电子流过导线,则理论上产生0.5mol H2 |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极 (填“锌极”或“铜极”)
6.25℃时,有关物质的电离平衡常数如下:
(1)CH3COOH溶液中,其电离平衡常数表达式为K=$\frac{{c({H^+})•c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$,常温下测得NaHSO3溶液的pH<7,其原因是HSO3-的电离程度大于其水解程度.
(2)常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
(4)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是①>②=③(填序号).
(5)已知,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为CO32->SO32->CH3COO->HSO3-.
(4)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是①>②=③(填序号).
(5)已知,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
13.下列说法正确的是( )
①离子化合物含离子键,也可能含极性键或非极性键
②HClO酸性<H2CO3酸性,故非金属性Cl<C
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的化合物是离子化合物
⑥由分子组成的物质中一定存在共价键.
①离子化合物含离子键,也可能含极性键或非极性键
②HClO酸性<H2CO3酸性,故非金属性Cl<C
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤熔融状态能导电的化合物是离子化合物
⑥由分子组成的物质中一定存在共价键.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①②③⑤ | D. | ①③⑤⑥ |
18.汽车的启动电源常用铅蓄电池,放电时的电池反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O,下列说法正确的是( )
| A. | PbO2是电池的负极 | |
| B. | 正极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | H2SO4起传导电子的作用 | |
| D. | 电池放电时,溶液pH增大 |

 .
. 充分还原的产物与其充分催化氧化的产物发生酯化反应,其中含有一个酯基的产物种类是( )(不考虑立体异构)
充分还原的产物与其充分催化氧化的产物发生酯化反应,其中含有一个酯基的产物种类是( )(不考虑立体异构)