题目内容
草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.草酸在100℃开始升华,157℃时大量升华,并开始分解.
(1)(NH4)2C2O4溶液的pH 7(填“>”或“<”或“=”).
(2)用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC-COOH),阴极的电极反应式为 .
(3)草酸钠是一种重要的还原剂.合成草酸钠的操作如下:
草酸
草酸钠晶体
①75%酒精的作用是 .
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列 .
(4)已知某温度下CaC2O4的Ksp为2.5×10-9.将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,所得溶液中C2O42-的物质的量浓度为 .
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3?H2O?NH4++OH- | K=1.8×10-5 |
(2)用惰性电极电解饱和草酸溶液可制得乙醛酸(OHC-COOH),阴极的电极反应式为
(3)草酸钠是一种重要的还原剂.合成草酸钠的操作如下:
草酸
| Na2CO3 |
| 加热 |
| 75%酒精 |
| 过滤 |
①75%酒精的作用是
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列
(4)已知某温度下CaC2O4的Ksp为2.5×10-9.将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,所得溶液中C2O42-的物质的量浓度为
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;
(2)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(3)①75%酒精,溶解碳酸钠,降低草酸钠的溶解度;
②草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7,溶液显酸性,Na+不水解,浓度最大,该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
(4)将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol?L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为
=
=2.5×10-7mol?L-1.
(2)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(3)①75%酒精,溶解碳酸钠,降低草酸钠的溶解度;
②草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7,溶液显酸性,Na+不水解,浓度最大,该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
(4)将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol?L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为
| Ksp |
| c(Ca2+) |
| 2.5×10-9 |
| 0.01 |
解答:
解:(1)由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;故答案为:<;
(2)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
故答案为:HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(3)①75%酒精,溶解碳酸钠,降低草酸钠的溶解度;
故答案为:溶解碳酸钠,降低草酸钠的溶解度;
②草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7,溶液显酸性,Na+不水解,浓度最大,该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
故答案为:c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
(4)将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol?L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为
=
=2.5×10-7mol?L-1;
故答案为:2.5×10-7mol?L-1.
(2)用惰性电极电解饱和草酸溶液,草酸在阴极放电,C由+3价降到+1价,得到2个电子,电极反应式为HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
故答案为:HOOC-COOH+2e-+2H+=OHC-COOH+H2O;
(3)①75%酒精,溶解碳酸钠,降低草酸钠的溶解度;
故答案为:溶解碳酸钠,降低草酸钠的溶解度;
②草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7,溶液显酸性,Na+不水解,浓度最大,该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
故答案为:c(Na+)>c(CO32-)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-);
(4)将0.02mol?L-1澄清石灰水和0.01mol?L-1H2C2O4溶液等体积混合,c(Ca2+)=0.01mol?L-1,根据CaC2O4的Ksp为2.5×10-9,所得溶液中C2O42-的物质的量浓度为
| Ksp |
| c(Ca2+) |
| 2.5×10-9 |
| 0.01 |
故答案为:2.5×10-7mol?L-1.
点评:本题考查已二酸的分解以及溶液离子浓度的大小比较,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质.

练习册系列答案
相关题目
物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的
(同温同压下),此时N2、O2、CO2的物质的量之比为( )
| 8 |
| 9 |
| A、1:1:0 |
| B、6:9:0 |
| C、3:4:1 |
| D、3:3:2 |
下列依据相关实验得出的结论正确的是( )
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定含有Na+ |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| D、向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
下列各对物质能发生离子反应的是( )
| A、AgNO3,KClO3 |
| B、Na2CO3,H2SO4 |
| C、Cu,盐酸 |
| D、Na2CO3,K2SO4 |
用胆矾(CuSO4?5H2O)配制0.2mol/L的CuSO4溶液,下列操作正确的是( )
| A、取50g胆矾溶于1L水中 |
| B、取50g胆矾溶于水配成1L溶液 |
| C、取32g胆矾溶于水配成1L溶液 |
| D、将胆矾加热除去结晶水,再取无水CuSO432g溶于1L水中 |
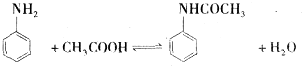

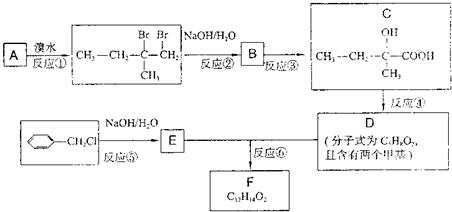
 将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:
将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题: