题目内容
 将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:
将0.1mol的镁和铝的混合物溶于50mL 4mol?L-1 H2SO4溶液中,然后再滴加2mol?L-1的NaOH溶液.请回答下列问题:(1)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积.
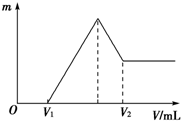
(2)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示.当V1=80mL时,计算金属粉末中镁的物质的量及V2的体积.
考点:镁、铝的重要化合物
专题:
分析:(1)镁铝的混合物溶于稀硫酸溶液中,发生反应生成硫酸镁和硫酸铝,然后再滴入氢氧化钠溶液,氢氧化钠体积小于V1ml时,和没有反应的硫酸反应,故0~V1ml时,不产生沉淀,氢氧化钠体积为V1ml~V时,硫酸镁和硫酸铝和氢氧化钠反应生成氢氧化镁和氢氧化铝,氢氧化钠体积为V~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V时,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为SO42-,即溶液中的溶质为Na2SO4,n(Na+)=2n(SO42-),其中Na+来自NaOH,SO42-来自H2SO4,故当氢氧化钠体积为V时,n(NaOH)=2n(H2SO4);
(2)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol?L-1硫酸溶解后,再加入450mL 1mol?L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol?L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1.
(2)若混合物仍为0.1mol,其中镁的物质的量分数为a,用100mL2mol?L-1硫酸溶解后,再加入450mL 1mol?L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1mol?L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,求得:Al(OH)3最大取值0.05mol,即0<n(Al)≤0.05mol,n(Mg)+n(Al)=0.1mol,则0.5≤n(Mg)<1.
解答:
解:(1)镁铝的混合物溶于稀硫酸溶液中,发生反应生成硫酸镁和硫酸铝,然后再滴入氢氧化钠溶液,氢氧化钠体积小于V1ml时,和没有反应的硫酸反应,故0~V1ml时,不产生沉淀,氢氧化钠体积为V1ml~V时,硫酸镁和硫酸铝和氢氧化钠反应生成氢氧化镁和氢氧化铝,氢氧化钠体积为V~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,当氢氧化钠体积为V时,镁离子和铝离子恰好沉淀,溶液中阳离子为Na+,阴离子为SO42-,即溶液中的溶质为Na2SO4,n(Na+)=2n(SO42-),其中Na+来自NaOH,SO42-来自H2SO4,故当氢氧化钠体积为V时,n(NaOH)=2n(H2SO4)=2×4mol?L-1×0.05L=0.4mol,v(NaOH)=
=
=200mL;
答:欲使Mg2+、Al3+刚好沉淀完全,滴入NaOH溶液的体积为200ml;
(2)设0.1mol镁铝的混合物中镁、铝的物质的量分别为x和y,x+y=0.1mol①,
氢氧化钠体积小于80ml时不产生沉淀,此时氢氧化钠和没有反应的硫酸反应,和硫酸反应的氢氧化钠物质的量=0.08L×2mol?L-1=0.16mol,
2NaOH+H2SO4=Na2SO4+2H2O
0.16mol 0.08mol
镁铝和硫酸反应,消耗的硫酸应该为:0.05L×4mol?L-1-0.08mol=0.12mol
发生的反应分别为:Mg+H2SO4=MgSO4+H2,2Al+3H2SO4=Al2(SO4)3+3H2,
x x y
y
则:x+
y═0.12mol②
由式①②可得x=0.06mol,y=0.04mol;即镁、铝的物质的量分别为0.06mol和0.04mol,氢氧化钠体积为V时生成Mg(OH)2和Al(OH)3物质的量分别0.06mol和0.04mol;
氢氧化钠体积为V~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,
0.04mol 0.04mol
Al(OH)3 和NaOH反应消耗NaOH0.04mol,v(NaOH)=
=
=0.02L=20ml;即:V~v2时氢氧化钠为20ml,0~V消耗200ml氢氧化钠,V2=220 mL;
故答案为:金属粉末中镁的物质的量为0.06mol及V2的体积为220ml;
| n(NaOH) |
| c(NaOH) |
| 0.4 |
| 2 |
答:欲使Mg2+、Al3+刚好沉淀完全,滴入NaOH溶液的体积为200ml;
(2)设0.1mol镁铝的混合物中镁、铝的物质的量分别为x和y,x+y=0.1mol①,
氢氧化钠体积小于80ml时不产生沉淀,此时氢氧化钠和没有反应的硫酸反应,和硫酸反应的氢氧化钠物质的量=0.08L×2mol?L-1=0.16mol,
2NaOH+H2SO4=Na2SO4+2H2O
0.16mol 0.08mol
镁铝和硫酸反应,消耗的硫酸应该为:0.05L×4mol?L-1-0.08mol=0.12mol
发生的反应分别为:Mg+H2SO4=MgSO4+H2,2Al+3H2SO4=Al2(SO4)3+3H2,
x x y
| 3 |
| 2 |
则:x+
| 3 |
| 2 |
由式①②可得x=0.06mol,y=0.04mol;即镁、铝的物质的量分别为0.06mol和0.04mol,氢氧化钠体积为V时生成Mg(OH)2和Al(OH)3物质的量分别0.06mol和0.04mol;
氢氧化钠体积为V~v2时氢氧化铝和氢氧化钠反应,生成偏铝酸钠,Al(OH)3 +NaOH=NaAlO2+2H2O,
0.04mol 0.04mol
Al(OH)3 和NaOH反应消耗NaOH0.04mol,v(NaOH)=
| n(NaOH) |
| c(NaOH) |
| 0.04mol |
| 2mol?L -1 |
故答案为:金属粉末中镁的物质的量为0.06mol及V2的体积为220ml;
点评:本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,

练习册系列答案
相关题目
“秦砖汉瓦”是我国传统建筑文化的一个缩影.同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能( )
| A、土壤中含有铁粉、二氧化锰等 |
| B、黑砖瓦是煅烧过程中附着了炭黑,红砖则是添加了红色耐高温染料 |
| C、土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu或Cu2O |
| D、土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe304或FeO和红色Fe2O3 |
 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A、如图中a点对应的是AgBr的不饱和溶液 |
| B、在t℃时,Ksp(AgBr)=4.9×10-13 |
| C、在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
| D、在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点 |
下列关于金属的叙述正确的是( )
| A、为解决当下能源紧却问题,可大力发展冶炼铝工业 |
| B、我国使用最早的合金是黄铜 |
| C、人类对镁的使用比铁更早,镁的合金具有质量轻、硬度较大的优点 |
| D、目前用量最大,使用最广的合金是钢 |
在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应的化合物是( )
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3.
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3.
| A、①②③⑤ | B、①③④⑤ |
| C、②③⑤ | D、②④⑤ |
下列说法错误的是( )
| A、化学是在分子、原子水平上认识物质,了解化学可以改变分子、创造出新的分子 |
| B、医疗上所用“钡餐”使用的是氯化钡 |
| C、氮化硅陶瓷、通讯光缆等都是新型无机非金属材料 |
| D、盐卤能使蛋白质变性,因此喝不得,但可以用盐卤做豆腐 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、使甲基橙变红的溶液:K+、Na+、SO42-、CO32- |
| B、pH=7的溶液中:Fe3+、K+、SO42-、Br- |
| C、c(H+)/c (OH-)═104的溶液:K+、Ba2+、NO3-、Cl- |
| D、水电离出的c(H+)═1.0×10-13 mol?L-1的溶液中:SO42-、K+、Cl-、Fe3+ |
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A、气态氢化物稳定性:W>Y |
| B、Z与Q形成的化合物水溶液不一定显酸性 |
| C、Y的单质比W的单质沸点高 |
| D、原子半径从大到小排列是:Z>X>Y>W>Q |