题目内容
6.下列物质中,既可用浓H2SO4干燥,又可用碱石灰干燥的是( )| A. | Cl2 | B. | O2 | C. | SO2 | D. | NH3 |
分析 能用浓H2SO4干燥,又能用碱石灰(氧化钙和氢氧化钠)干燥,说明该气体为中性气体,且不能被浓硫酸氧化,据此进行解答.
解答 解:能用浓H2SO4干燥,又能用NaOH固体这说明该气体不能与这两者反应,
Cl2、SO2能够与碱反应,不能用碱石灰干燥;NH3是碱性气体,能与硫酸反应,不能用浓硫酸干燥;
只有O2既不与酸反应也不与碱反应,则既可用浓H2SO4干燥,又可用碱石灰干燥,
故选B.
点评 本题考查了常见气体的净化与干燥方法,题目难度不大,明确常见气体的性质为解答关键,注意掌握常见干燥剂的组成、性质及检验方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.(1)已知元素M是组成物质NH4Al(SO4)2的一种元素.元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
元素M是Al(填写元素符号),该元素属于p区.
(2)硫原子核外有16种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
| I1 | I2 | I3 | I4 | |
| 电离能(kJ•mol-1) | 578 | 1 817 | 2 745 | 11 578 |
(2)硫原子核外有16种不同运动状态的电子,其基态原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
14.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
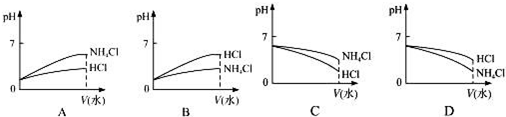
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).
(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
| 实验编号 | 氨水物质的量浓度/ (mol•L-1) | 盐酸物质的量浓度/ (mol•L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
(1)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)=1×10-5mol•L-1;从第②组情况表明,c (填“>”“<”或“=”)0.2mol•L-1;从第③组情况分析可知,混合溶液中c(NH4+)>(填“>”“<”或“=”)c(NH3•H2O).
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下面图象正确的是B(填图象符号).

(3)向25mL 0.10mol•L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是ABC.
A.c(C1-)=c(NH4+)>c(H+)=c(OH-)B.c(C1-)>c(NH4+)=c(H+)>c(OH-)
C.c(NH4+)>c(OH-)>c(C1-)>c(H+)D.c(OH-)>c(NH4+)>c(H+)>c(C1-)
1.将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )

| A. | 甲装置中电能转化为化学能 | B. | 乙装置中电能转化为化学能 | ||
| C. | 乙装置中铜片表面有气泡生成 | D. | 甲装置中铜片表面有气泡产生 |
11.用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 23gNa在氧气中完全燃烧失去NA个电子 | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LH2O含有NA个分子 | |
| D. | 1L0.5 mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA |
18.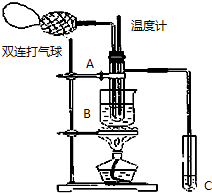 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH(注明反应条件).
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末;实验仪器任选.该方案为方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成.
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH(注明反应条件).
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A的支管口处,目的是收集含乙酸的馏分.
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是乙二醇或甘油(写出一种即可,在题给物质中找).
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末;实验仪器任选.该方案为方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸;
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成.
16.下列电子式错误的是( )
| A. |  | B. |  | C. |  | D. |  |
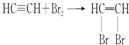
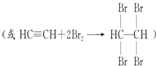 .
.

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.