题目内容
3.某化学课外小组用含铜96%的废铜屑制取胆矾,将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成CuSO4.(1)现用1kg这种废铜屑理论上能制取胆矾3.75kg.
(2)将这种胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成杀菌剂波尔多液.
①此波尔多液中Cu2+和Ca2+的物质的量之比为2:5(最简整数比)
②波尔多液有效成分的化学式可表示为CuSO4•xCu(OH)2•yCa(OH)2•zH2O,此种配比当x=1时,y的数值为4.
分析 (1)依据铜元素守恒计算得到;
(2)①依据胆矾与生石灰、水按质量比依次为1:0.56:100混合液中质量计算物质的量之比;
②依据化学式CuSO4•xCu(OH)2•yCa(OH)2,此种配比当x=1时,CuSO4+Ca(OH)2→Cu(OH)2+CaSO4.
解答 解:(1)铜元素守恒计算得到,设生成胆矾质量为x
Cu~CuSO4•5H2O
64 250
1kg×96% x
x=$\frac{1×0.96}{64}$×250=3.75(kg);
故答案为:3.75;
(2)①胆矾与生石灰、水按质量比依次为1:0.56:100混合,Cu2+离子和Ca2+离子的物质的量比=$\frac{1}{250}$:$\frac{0.56}{56}$=2:5;
故答案为:2:5;
②CuSO4+Ca(OH)2→Cu(OH)2+CaSO4
反应前 2 5 0 0
反应后 1 4 1 1
∴CuSO4•Cu(OH)2•yCa(OH)2中 y=4;
故答案为:4.
点评 本题考查了化学方程式的计算应用,物质制备过程的分析判断,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列各组离子在水溶液中能大量共存的是( )
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Ca2+、HCO3-、C1-、K+ | D. | H+、Cl-、Na+、CO32- |
18.检验某未知液中是否含有SO42-的下列操作最合理的是( )
| A. | 加入硝酸酸化了的硝酸钡溶液,有白色沉淀生成 | |
| B. | 加入盐酸酸化了的氯化钡溶液,有白色沉淀生成 | |
| C. | 先加硝酸酸化,无沉淀,再加硝酸钡溶液,有白色沉淀生成 | |
| D. | 先加盐酸酸化,无现象,再加氯化钡溶液,有白色沉淀生成 |
8.下列说法正确的是( )
| A. | 12C、13C、14C、C60都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
12.下列有关同分异构体数目的叙述中,不正确的是( )
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
| B. | 结构简式为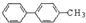 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| C. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| D. | 菲的结构简式为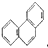 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
13.某化学小组欲探究常见铁的化合物的氧化性和还原性.请回答下列问题:
(1)请帮助他们完成以下实验报告:
【实验目的】探究铁的化合物的氧化性和还原性
【所用试剂】铁粉、锌片、铜粉、FeCl3溶液、FeCl2溶液、氯水
实验记录
【实验结论】Fe3+有氧化性;Fe2+既有氧化性,又有还原性.
(2)亚铁盐在溶液中易被氧化,保存亚铁盐溶液时常加入某种试剂防止亚铁盐被氧化.所加的试剂是加入少量铁粉.
(1)请帮助他们完成以下实验报告:
【实验目的】探究铁的化合物的氧化性和还原性
【所用试剂】铁粉、锌片、铜粉、FeCl3溶液、FeCl2溶液、氯水
实验记录
| 序号 | 实验内容 | 实验观察 | 离子方程式 | 解释与结论 |
| ① | 在FeCl2溶液中 滴入适量氯水 | 溶液由浅绿色 变为黄色 | 2Fe2++Cl2═2Fe3++2Cl- | Fe2+具有还原性 |
② | 在FeCl2溶液中 加入锌片 | / | Zn+Fe2+=Zn2+ +Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中 加入足量铁粉 | 溶液由黄色变成浅绿色 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 |
④ | 在FeCl3溶液中 通入H2S气体 | 溶液变为浅绿色并 有淡黄色沉淀生成 | H2S+2Fe3+=2Fe2++S↓+2H+ | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,保存亚铁盐溶液时常加入某种试剂防止亚铁盐被氧化.所加的试剂是加入少量铁粉.
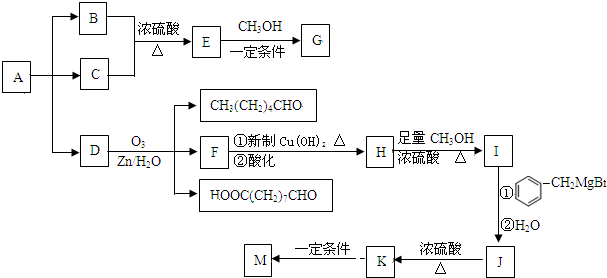
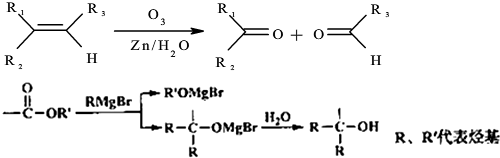
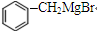 →
→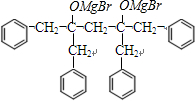 +2CH3OMgBr;
+2CH3OMgBr;