题目内容
15.根据已学知识,请你回答下列问题:(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式图:3d64s2.
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是硒.
(3)根据VSEPR模型,SeO3的分子立体结构为:平面三角形.
(4)第二周期元素原子的第一电离能从大到小的顺序为Ne、F、N、O、C、Be、B、Li(用元素符号作答).
(5)气态HCl溶于水,破坏了HCl分子的共价键
(6)根据等电子体原理,与CO分子互为等电子体的是:N2,则推断CO分子的结构式为:C≡O
(7)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用方程式FeCl3+3KSCN═Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1:1配合所得离子显红色.含该离子的配合物的化学式是[Fe(SCN)]Cl2.
分析 (1)原子序数最小的第Ⅷ族元素为Fe元素,据此写外围电子排布式;
(2)根据原子的外围电子排布是4s24p4,确定该原子名称;
(3)根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
(4)同周期随原子序数增大第一电离能呈增大趋势,但第二周期中,铍元素原子2s能级容纳2个电子,处于全满稳定状态,能量较大,失去电子较难,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量较大,失去电子较难;
(5)物质发生化学反应或电解质溶于水或熔融状态都发生化学键被破坏;
(6)原子数电子数相等的微粒叫等电子体,等电子体结构相似;
(7)Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,据此判断FeCl3与KSCN在水溶液中的反应产物.
解答 解:(1)原子序数最小的第Ⅷ族元素为铁元素,其外围电子排布式为3d64s2,
故答案为:3d64s2;
(2)原子的外围电子排布是4s24p4,说明该原子中各个轨道都充满电子,该原子核外电子数是34,所以是硒元素,
故答案为:硒;
(3)气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,
故答案为:平面三角形;
(4)同周期随原子序数增大第一电离能呈增大趋势,但第二周期中,铍元素原子2s能级容纳2个电子,处于全满稳定状态,能量较大,失去电子较难,第一电离能高于B元素,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量较大,失去电子较难,第一电离能高于O元素,故第二周期元素第一电离能的排列顺序由大到小排列的为:Ne、F、N、O、C、Be、B、Li,
故答案为:Ne、F、N、O、C、Be、B、Li;
(5)HCl在水分子的作用下电离出阴阳离子,所以H-Cl共价键被破坏,
故答案为:共价键;
(6)N2、CO的原子数都是2,价电子数都是10,则互为等电子体,N2分子的结构式为:N≡N,等电子体结构相似,则CO分子的结构式为:C≡O,
故答案为:N2;C≡O;
(7)Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,所以FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl,
故答案为:[Fe(SCN)]Cl2.
点评 本题考查了较综合,涉及外围电子排布式、粒子空间构型判断、元素周期律等知识点,这些知识点都是高考高频点,价层电子对互斥理论、元素周期律等知识熟练掌握是解答关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案
| A. | b和c是同分异构体 | B. | a和d是同分异构体 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
| 元素 | 原子结构或性质 |
| A | 原子最外层电子数是内层电子总数的1/5 |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
(1)A在元素周期表中的位置是第三周期ⅡA族.
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.
(3)用电子式表示MgCl2的形成过程
 .
.  表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 36种 | B. | 32种 | C. | 27种 | D. | 18种 |
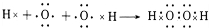
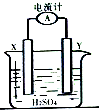 某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.
某同学进行如图所示的铜--锌原电池实验,已知电解质溶液中H+向X极移动.