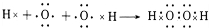题目内容
18.检验某未知液中是否含有SO42-的下列操作最合理的是( )| A. | 加入硝酸酸化了的硝酸钡溶液,有白色沉淀生成 | |
| B. | 加入盐酸酸化了的氯化钡溶液,有白色沉淀生成 | |
| C. | 先加硝酸酸化,无沉淀,再加硝酸钡溶液,有白色沉淀生成 | |
| D. | 先加盐酸酸化,无现象,再加氯化钡溶液,有白色沉淀生成 |
分析 检验某未知溶液中是否含有SO42-,应先加盐酸排除其它离子的干扰如碳酸根离子、亚硫酸根离子、银离子等的干扰,再加氯化钡,以此来解答.
解答 解:A.加入HNO3酸化了的Ba(NO3)2溶液,若为亚硫酸根离子也生成白色沉淀,不能检验,故A错误;
B.加入HCl酸化了的BaCl2溶液,生成白色沉淀可能为AgCl,不能检验,故B错误;
C.先加入HNO3酸化,若为亚硫酸根离子,亚硫酸根离子被硝酸氧化成硫酸根离子,再加Ba(NO3)2,生成白色沉淀硫酸钡,不能检验,故C错误;
D.先加入盐酸酸化,以除去 SO32-、CO32- 等离子的影响,同时,当加入稀盐酸时没有沉淀,可排除Ag+的影响,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,故D正确;
故选D.
点评 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意检验离子的试剂及试剂的加入顺序,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.据报道,科学家已成功合成了少量O4(其结构式是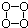 ),有关O4的说法正确的是( )
),有关O4的说法正确的是( )
 ),有关O4的说法正确的是( )
),有关O4的说法正确的是( )| A. | O4的摩尔质量是64g | |
| B. | O4和O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数比为4:3 | |
| D. | O4与O3、O2都是氧元素的同素异形体 |
9.原子序数为Z的元素在周期表中位于A、B、C、D四种元素的中间,则A、B、C、D四种元素的原子序数之和(如图所示)不正确的是(镧、锕系元素除外;且A、B、C、D中间再无其他元素)( )


| A. | 4Z | B. | 4Z+6 | C. | 4Z+10 | D. | 4Z+14 |
6.有4种碳架如下的烃,下列说法中正确的是( )


| A. | b和c是同分异构体 | B. | a和d是同分异构体 | ||
| C. | a和d都能发生加成反应 | D. | 只有b和c能发生取代反应 |
8.美国“海浪”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法错误的是( )
| A. | 铝钠合金是混合物 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| D. | 若mg不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
 A、B、C、D、E、F六种元素的原子序数依次递增.已知:
A、B、C、D、E、F六种元素的原子序数依次递增.已知: