题目内容
6.下列各组离子在指定条件下可能大量共存的是( )| A. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+ )•c(OH- )=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
分析 A.碳酸根离子、次氯酸根离子水解后溶液呈碱性,能够使酚酞变红;
B.该溶液中存在大量氢离子或氢氧根离子,硝酸根离子在酸性条件下与铝反应不会生成氢气,铵根离子与氢氧根离子反应;
C.该溶液促进了水的电离,溶液呈酸性或碱性,四种离子之间不反应,都不与氢氧根离子反应;
D.铁离子为有色离子,且铁离子与碳酸氢根离子发生双水解反应.
解答 解:A.CO32-、ClO-离子发生水解,溶液呈碱性,能够使酚酞溶液变红,故A错误;
B.能与金属铝反应放出氢气的溶液呈酸性或强碱性,NO3-在酸性条件下具有强氧化性,与Al反应不会生成氢气,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.常温下水电离出的c(H+ )•c(OH- )=10-20的溶液促进了水的电离,溶液呈酸性或碱性,Na+、Cl-、S2-、SO32-在不反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故C正确;
D.Fe3+为有色离子,HCO3-、Fe3+之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
16.在2L0.1mol•L-1 Na2SO4溶液中,下列说法正确的是( )
| A. | Na+物质的量为0.2mol | B. | Na+物质的量浓度为0.2 mol•L-1 | ||
| C. | SO42-物质的量为0.1mol | D. | SO42-物质的量浓度为0.2 mol•L-1 |
17.已知2H2O2(1)═2H2O(1)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( )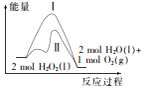

| A. | 该反应的△H<0,△S>0 | |
| B. | 途径Ⅱ与途径I相比,可能是加了催化剂 | |
| C. | 其他条件相同时,产生相同体积的氧气时放出的热量:途径I>途径Ⅱ | |
| D. | 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ |
14.下列不能说明硫的非金属性比氯的非金属性弱的是( )
| A. | 硫酸比次氯酸稳定 | B. | 硫酸的酸性弱于高氯酸 | ||
| C. | H2S比HCl被氧化 | D. | 气态HC1比气态H2S稳定 |
1.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 金属元素和非金属分界线附近的元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 稀有气体元素 |
11.根据对角线规则,下列物质的性质具有相似性的是( )
| A. | 硼和硅 | B. | 铝和铁 | C. | 碳和铝 | D. | 铜和金 |
20.下列各组有机物,不论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗氧气的物质的量和生成水的物质的量分别相等的是( )
| A. | 乙醛和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
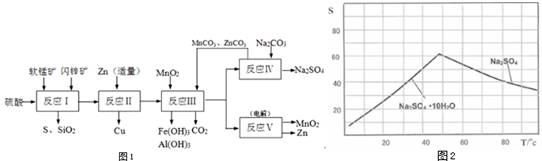
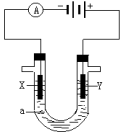 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题: