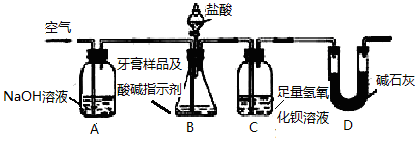
题目内容
11.根据对角线规则,下列物质的性质具有相似性的是( )| A. | 硼和硅 | B. | 铝和铁 | C. | 碳和铝 | D. | 铜和金 |
分析 元素周期表中,某些主族元素与右下方的主族元素的性质具有相似性,这种规律被称为“对角线规则”,根据元素的位置情况来判断.
解答 解:A.硼和硅位于对角线位置,性质相似,故A正确;
B.铝为主族元素,铁为过渡金属,不位于对角线位置,故B错误;
C.碳和铝不对角线规则,物质的性质不相似,故C错误;
D.铜和金都为ⅠB族元素,不处于对角线,故D错误.
故选A.
点评 本题考查学生对对角线规则的认识情况:沿周期表中金属与非金属分界线方向对角的两主族元素性质相似,注意知识的理解和应用是关键,难度中等.

练习册系列答案
相关题目
1.元素在周期表中的位置反映了元素的性质.第3周期元素中,原子半径最大的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
2.下列关于晶体的说法,不正确的是( )
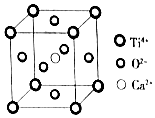
( Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)

( Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 该晶体中每个Ti4+和8个O2-相紧邻 | |
| C. | 一个CO2晶胞中平均含有4个CO2分子 | |
| D. | 金属晶体的熔点可能比分子晶体的熔点低 |
19.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
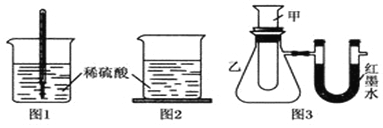
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
根据上述实验回答相关问题:
(1)方案一中,温度先升高的原因是铝和硫酸反应放出的热量使烧杯里溶液的温度升高,
升至最大值后又逐渐下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(2)方案二中,小木片脱落的原因是氢氧化钠与硫酸的反应放热.
(3)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应.
(4)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.

方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)方案一中,温度先升高的原因是铝和硫酸反应放出的热量使烧杯里溶液的温度升高,
升至最大值后又逐渐下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(2)方案二中,小木片脱落的原因是氢氧化钠与硫酸的反应放热.
(3)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应.
(4)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
6.下列各组离子在指定条件下可能大量共存的是( )
| A. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+ )•c(OH- )=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
16.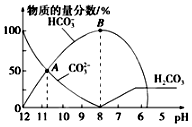 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
7.某研究小组经查阅资料得知:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO3↑+SO2↑;FeSO4$\frac{\underline{\;高温\;}}{\;}$FeO+SO3↑,SO3的熔点是16.8℃,沸点是44.8℃.
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.
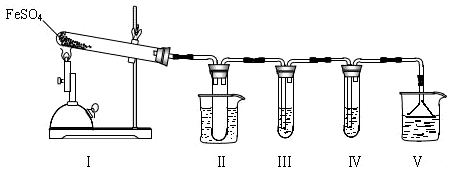
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
Ⅱ.FeSO4固体往往含有Fe2(SO4)3杂质,该研究小组采用称重法确定固体中铁元素的质量分数,操作流程为:

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是A
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为过滤、洗涤、灼烧.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为70%.
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.

(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是A
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为过滤、洗涤、灼烧.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为70%.
5.下列关于有机物的说法中正确的是( )
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 3.0 g 甲醛和乙酸的混合物中含有的原子总数为0.6NA | |
| D. | 0.1 mol C2H6O分子中含有C-H键数为0.5NA |