题目内容
11.已知:H2O(g)═H2O(l)△H=Q1 kJ•mol-1C2H5OH(g)═C2H5OH(l)△H=Q2 kJ•mol-1
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=Q3 kJ•mol-1
若使46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
分析 ①H2O(g)═H2O(l)△H1=Q1kJ•mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=Q2kJ•mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJ•mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
n(C2H5OH)=$\frac{46g}{46g/mol}$=1mol,结合物质的量与热量成正比计算.
解答 解:①H2O(g)═H2O(l)△H1=Q1kJ•mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=Q2kJ•mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=Q3kJ•mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(3Q1-Q2+Q3)kJ/mol,
n(C2H5OH)=$\frac{46g}{46g/mol}$=1mol,则46g酒精液体完全燃烧,最后恢复到室温,则放出的热量为-(3Q1-Q2+Q3) kJ,
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意焓变与热量不同,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.25℃时加水稀释10mL pH=11的氨水,下列判断正确的是( )
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
2.硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺流程如下图所示:
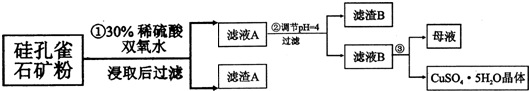
(1)步骤1中先加入足量稀硫酸,再加人双氧水.则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.A12O3 B.CuO C.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
则滤液B中含有的阳离子是Al3+、H+、Cu2+.
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4.取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol.则a=$\frac{2}{5}$b-8.(氧气占空气体积的五分之一)

(1)步骤1中先加入足量稀硫酸,再加人双氧水.则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.A12O3 B.CuO C.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是CuS+2O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CuSO4.取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol.则a=$\frac{2}{5}$b-8.(氧气占空气体积的五分之一)
3.下列实验操作中,所用仪器使用合理的是( )
| A. | 在容量瓶中溶解氢氧化钠固体并配制溶液 | |
| B. | 用100mL的量筒量取5.2mL的盐酸 | |
| C. | 用托盘天平称取25.2gNaCl | |
| D. | 用分液漏斗来过滤NaCl溶液中泥沙 |
1.下列各离子能大量共存的是( )
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
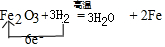 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.