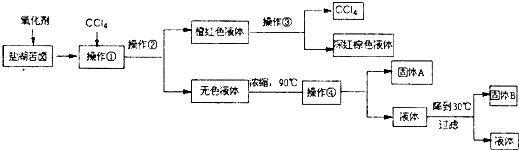
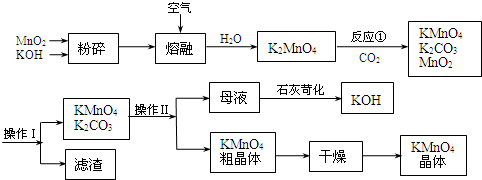
题目内容
甲、乙两容器都发生反应2A(g)+B(g)?3C(g),两容器温度和初始压强都相同.在甲恒容容器中充入2mol A和1mol B,达平衡后,C在平衡混合气中的体积分数为φ1、物质的量为n1;在乙恒压容器中充入1.4mol A、0.7mol B和0.6mol C,达平衡后C在平衡混合气中的体积分数为φ2、物质的量为n2.下列说法中正确的是( )
| A、φ1>φ2 |
| B、n1>n2 |
| C、n1=n2 |
| D、φ1<φ2 |
考点:化学平衡的计算
专题:
分析:反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,反应前后气体体积相等,气体的物质的量始终不变,所以n1等于2mol+1mol=3mol,n2等于1.4mol+0.7mol+0.6molC=2.7mol,即n1必大于n2;
体积分数的计算可以根据一边倒,容器中充入1.4mol A、0.7mol B和0.6mol C,相当于容器中充入1.8mol A和0.9mol B,由于反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,所以甲乙容器中平衡为等效平衡,φ1═φ2.
体积分数的计算可以根据一边倒,容器中充入1.4mol A、0.7mol B和0.6mol C,相当于容器中充入1.8mol A和0.9mol B,由于反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,所以甲乙容器中平衡为等效平衡,φ1═φ2.
解答:
解:反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,反应前后气体体积相等,气体的物质的量始终不变,所以n1等于2mol+1mol=3mol,n2等于1.4mol+0.7mol+0.6molC=2.7mol,即n1>n2;
由于反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,根据一边倒,容器中充入1.4mol A、0.7mol B和0.6mol C,相当于容器中充入1.8mol A和0.9mol B,由于甲乙两容器中A与B的物质的量成比例,所以甲乙容器中平衡为等效平衡,则φ1═φ2.
故选:B.
由于反应2A(g)+B(g)?3C(g)是一个气体体积不变的反应,根据一边倒,容器中充入1.4mol A、0.7mol B和0.6mol C,相当于容器中充入1.8mol A和0.9mol B,由于甲乙两容器中A与B的物质的量成比例,所以甲乙容器中平衡为等效平衡,则φ1═φ2.
故选:B.
点评:本题考查等效平衡,题目偏难,理解等效平衡规律为解答本题的关键,如:1、恒温恒容条件下,若反应前后气体体积不等,按化学计量数转化一边,对应物质满足等量;若反应前后气体体积相等,按化学计量数转化一边,对应物质满足等比;2、恒温恒压条件下,按化学计量数转化一边,对应物质满足等比即可.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
下列排列的顺序不正确的是( )
| A、离子半径:O2->Na+>Mg2+ |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、热稳定性:HCl>PH3>H2S |
| D、结合氢离子能力:CO32->HCO3->SO42- |
向浓度为0.1mol?L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是( )
| A、H2O |
| B、CO2 |
| C、KHSO4固体 |
| D、KOH固体 |