题目内容
15.下列说法正确的是( )| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
分析 A.物质的量不能表示宏观物质;
B.摩尔是物质的量的单位,不是物理量;
C.1mol任何物质都含有约6.02×1023个微粒;
D.0.012kg12C中所含的碳原子数为阿伏伽德罗常数数值.
解答 解:A.物质的量不能表示宏观物质,米粒是宏观物质,故A错误;
B.摩尔是物质的量的单位,不是物理量,物质的量是国际单位制中的七个基本物理量之一,故B错误;
C.1mol任何物质都含有约6.02×1023个微粒,如1molH2O中含有3mol原子,故C错误;
D.0.012kg12C中所含的碳原子数为阿伏伽德罗常数数值,其近似值为6.02×1023,故D正确;
故选D.
点评 本题考查了有关物质的量、摩尔质量、阿伏伽德罗常数等几个概念,侧重于基础知识的考查,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
6.下列现象或应用中,不能用胶体知识解释的是( )
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
3.既能与盐酸反应又能和氢氧化钠反应的氧化物是( )
| A. | Al2O3 | B. | Fe2O3 | C. | Al(OH)3 | D. | Fe(OH)3 |
10.下列事实不能用平衡移动原理解释的是( )
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 工业合成氨时采用铁触媒作反应的催化剂 | |
| C. | 工业生产硫酸的过程中使用过量的空气以提高SO2的转化率 | |
| D. | 将收集NO2气体的烧瓶密闭后放在装有热水的烧杯中,发生颜色变化 |
20.下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.8L0.1mol•L-1的KCl溶液 | B. | 0.2L0.2mol•L-1的HCl溶液 | ||
| C. | 0.3L0.2mol•L-1的MgCl2溶液 | D. | 0.5L 0.1mol•L-1的AlCl3溶液 |
7.下列反应的离子方程式中正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2O2与 H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 碳酸镁与稀盐酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
4.2016年3月10日,中科院上海光机所强场激光物理重点实验室宣布,其利用超强短激光成功产生反物质,这是我国科学家首次利用激光成功产生反物质.物质和反物质是对称的,反物质是由反粒子构成,反粒子的质量、寿命、自旋等与粒子完全相同,但所带电荷的电性相反.如果用反质子和反中子代替原子核中的质子和中子,就得到反原子核,再配以正电子,就形成反原子,反原子构成反分子,进而构成反物质.下列选项错误的是( )
| A. | 氢原子的结构示意图为: ;则反氢原子的结构示意图为: ;则反氢原子的结构示意图为: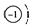 | |
| B. | 反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子 | |
| C. | 反氢原子的摩尔质量为1g/mol | |
| D. | 21H的反氢原子中有2个带负电荷的反质子 |
10.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
①可以判断该分解反应已经达到化学平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填>、<或=).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定上述反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
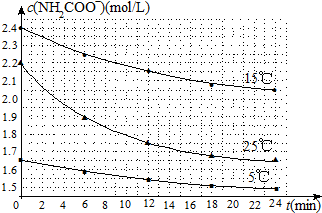
⑤计算25℃时,0~6min上述反应中氨基甲酸铵的平均速率0.05mol/(L•min).
⑥根据图中信息,如何说明上述反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:1.6×10-8.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加(填“增加”、“减小”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填>、<或=).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定上述反应速率,得到c(NH2COO-)随时间变化趋势如图所示.

⑤计算25℃时,0~6min上述反应中氨基甲酸铵的平均速率0.05mol/(L•min).
⑥根据图中信息,如何说明上述反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.