题目内容
19.如图为离子晶体空间构型示意图,则离子晶体的组成表达式不正确的是( )
| A. | XY | B. | XY2Z | C. | XY3 | D. | XY2 |
分析 根据微粒所在晶胞位置,利用均摊法计算微粒数目之比,得到化学式.
解答 解:A、图中X离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,Y离子个数=4×$\frac{1}{8}$=$\frac{1}{2}$,个数之比为1:1,其化学式为XY,故A正确;
B、图中X离子个数=8×$\frac{1}{8}$=1,Y离子个数=6×$\frac{1}{2}$=3,Y离子个数=1,个数之比为1:3:1,其化学式为XY3Z,故B错误;
C、图中X离子个数=4×$\frac{1}{8}$+1=1.5,Y离子个数=4×$\frac{1}{8}$+4×$\frac{1}{2}$+2=4.5,个数之比为1:3,其化学式为XY3,故C正确;
D、图中X离子个数=1,Y离子个数=4×$\frac{1}{8}$=0.5,个数之比为2:1,其化学式为X2Y,故D错误;
故选BD.
点评 本题考查晶胞计算,侧重考查分析计算能力,正确判断离子被几个晶胞占有是解本题关键,题目难度不大.

练习册系列答案
相关题目
10.用0.1000mol•L1 HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
①待测NaOH溶液的物质的量浓度为0.1392mol•L?1.(保留四位有效数字)
②下列情况可能引起测定结果偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.
| 实验序号 | 0.1000mol•L1 HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 20.00 |
| 2 | 25.53 | 20.00 |
| 3 | 27.85 | 20.00 |
②下列情况可能引起测定结果偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.到达滴定终点时,仰视读数
D.滴定前,滴定管中的溶液液面最低点在“0”点以下.
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为小于3NA | |
| B. | 0.1 mol Cl2完全溶于水,转移的电子数目为0.1NA | |
| C. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.25NA |
14.0.01mol•L-1H B溶液的pH=2,将溶液稀释100倍后,溶液的pH值可能为( )
| A. | 1 | B. | 4 | C. | 5 | D. | 8 |
4.X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子数的三倍.下列有关叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只能为离子化合物 | |
| C. | 氢化物的熔沸点:Y<Z | |
| D. | 氢化物的稳定性:Y>Z |
11.下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④ ,⑧
,⑧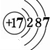 .
.
(3)在上述标出元素中,金属性最强的元素是K,非金属性最强的元素是_F,最不活泼的元素是Ar.(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是Na(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是Cl(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式OH-+H+═H2O
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式:CO2+NaOH═NaHCO3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
 ,⑧
,⑧ .
.(3)在上述标出元素中,金属性最强的元素是K,非金属性最强的元素是_F,最不活泼的元素是Ar.(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是Na(填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是Cl(填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式OH-+H+═H2O
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式:CO2+NaOH═NaHCO3.
8.把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
| A. | 盐酸的浓度 | B. | 铝条的表面积 | C. | 溶液的温度 | D. | 加少量NaCl固体 |
9.硫酸亚铁煅烧反应为2FeSO4(s)$\frac{\underline{\;高温\;}}{\;}$X(g)+Fe2O3(s)+SO3(g),有关说法正确的是( )
| A. | 该反应中X为还原产物 | |
| B. | X能使溴水褪色,说明X具有漂白性 | |
| C. | 该反应中每生成1molFe2O3转移电子数约为6.02×1023 | |
| D. | 该反应生成的气体通入足量Ba(NO3)2溶液中,可得到两种沉淀 |