题目内容
实验室用固体NaOH制配0.1mol/L的NaOH溶液500mL,有以下仪器:①烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥试管 ⑦药匙.
(1)配制时,必须使用的仪器有 (填代号),还缺少的仪器是 .
(2)实验两次用到玻璃棒,其作用分别是: 、 .
(3)配制时,一般操作步骤顺序为:①计算 ② ③ ④冷却 ⑤转移 ⑥洗涤 ⑦定容 ⑧摇匀.
(1)配制时,必须使用的仪器有
(2)实验两次用到玻璃棒,其作用分别是:
(3)配制时,一般操作步骤顺序为:①计算 ②
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据实验操作步骤确定每步操作需要仪器,然后判断还缺少仪器名称;
(2)根据配制步骤判断玻璃棒的作用;
(3)根据实验操作的步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作解答.
(2)根据配制步骤判断玻璃棒的作用;
(3)根据实验操作的步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作解答.
解答:
解:(1)配制0.1mol/L的NaOH溶液500mL,配制步骤有称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以给出的仪器必须使用的仪器有①②④⑤⑦;还需要药匙、胶头滴管,故答案为:①②④⑤⑦;天平、胶头滴管;
(2)实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,故答案为:搅拌;引流;
(3)根据实验操作的步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,故答案为:称量;溶解.
(2)实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,故答案为:搅拌;引流;
(3)根据实验操作的步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,故答案为:称量;溶解.
点评:本题考查配制一定物质的量浓度溶液的实验操作步骤和仪器,题目难度不大,注意容量瓶的使用方法.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、200mL1molAl2(SO4)3溶液中,Al3+和SO42-离子数的总和为NA |
| B、标准状况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1molNa完全被氧化生成Na2O2,转移电子的数目为0.1NA |
| D、0.1molO2和O3的混合气体中含氧原子数目为0.2NA |
对可逆反应2SO2(g)+O2 (g)?2SO3 (g),下列判断正确的是( )
| A、若单位时间内生成xmolSO3 的同时,消耗xmolSO2,则反应达到平衡状态 |
| B、达到化学平衡状态,2v正(O2)=v逆(SO3 ) |
| C、平衡时,SO2的浓度必定等于O2 浓度的2倍 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
下列方法中,正确的是( )
| A、用湿润的红色石蕊试纸检验氨气 |
| B、在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl- |
| C、将熟石灰和氯化铵混合加热,可以制备氨气 |
| D、加热试管中的氯化铵固体 |
下列关于Na2CO3和NaHCO3性质的说法错误的是( )
| A、热稳定性:NaHCO3<Na2CO3 |
| B、与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 |
| C、相同温度时,在水中的溶解性:NaHCO3<Na2CO3 |
| D、等物质的量浓度溶液的pH:NaHCO3<Na2CO3 |
 有机物A的结构简式如图,有关它的说法中正确的是( )
有机物A的结构简式如图,有关它的说法中正确的是( )| A、A遇FeCl3溶液显紫色 |
| B、A被酸性KMnO4溶液氧化可生成酸酸 |
| C、乙酸与A形成的脂的化学式是C12H14O3 |
| D、A能发生取代、加成、消去、氧化、聚合等反应 |


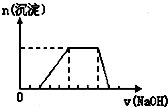 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是