题目内容
16. 化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究:查得资料:该牙膏磨擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅰ.磨擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水充分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.氢氧化铝与NaOH溶液反应的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.观察到的现象是通入CO2气体有白色沉淀生成,加入盐酸有气体产生,沉淀溶解.
Ⅱ.牙膏样品中碳酸钙的定量测定:利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气.A中NaOH溶液的作用:除去空气中CO2减少实验误差.
(4)C中反应生成BaCO3的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O.
(5)实验中准确称取10.00g样品,平均分成三份进行三次测定,每次都充分反应,测得每次BaCO3平均质量为1.97g.则样品中碳酸钙的质量分数为30%.
(6)测定C中生成的BaCO3沉淀质量所用的方法是:比较反应前后C装置的质量差.按如图所示装置,按正常的步骤进行实验,测定结果通常都偏高(填“偏高”或“偏低”),理由是B中的水蒸气、氯化氢气体等进入装置C中,导致增重(只答一个即可).
分析 增重A是空气通过除去空气中的二氧化碳气体,目的是排净装置内空气,把反应生成的二氧化碳全部排出到装置C中吸收,装置B中是样品和盐酸反应生成的气体通过装置C吸收,测定增重得到生成碳酸钡质量,结合碳元素守恒计算碳酸钙含量,装置D是防止空气中二氧化碳进入装置C影响测定结果,
Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水;
(2)往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O、HCO3-+H+=CO2↑+H2O;
Ⅱ.(3)实验通过C装置生成的碳酸钡的质量测定二氧化碳的质量,进而计算牙膏中碳酸钙的质量分数.装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
(4)二氧化碳与氢氧化钡反应生成碳酸钡与水;
(5)BaCO3质量为1.97g n(BaCO3)=0.0100mol,则n(CaCO3)=0.0100mol,质量为1.00g;
(6)装置B中的水蒸气和氯化氢气体会进入装置C.
解答 解:Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(2)往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O,HCO3-+H+=CO2↑+H2O,反应现象是通入CO2气体有白色沉淀生成;加入盐酸有气体产生,沉淀溶解,
故答案为:通入CO2气体有白色沉淀生成,加入盐酸有气体产生,沉淀溶解;
Ⅱ.(3)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收,A中NaOH溶液的作用是除去空气中CO2减少实验误差,
故答案为:除去空气中CO2减少实验误差;
(4)二氧化碳与氢氧化钡反应生成碳酸钡与水,反应方程式为CO2+Ba(OH)2═BaCO3↓+H2O,
故答案为:Ba(OH)2+CO2═BaCO3↓+H2O;
(5)BaCO3质量为1.97g,则n(BaCO3)=$\frac{1.97g}{197g/mol}$=0.01mol,则n(CaCO3)=0.01mol,质量为0.01mol×100g/mol=1g,所以实验中准确称取10.00g样品中含碳酸钙为3g,样品中碳酸钙的质量分数为 $\frac{3g}{10.0g}$×100%=30%,
故答案为:30%;
(6)B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
故答案为:偏高;B中的水蒸气、氯化氢气体等进入装置C中,导致增重.
点评 本题考查对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,难度中等,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出 | |
| B. | 中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度 | |
| C. | 用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量 | |
| D. | 用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里 |
| A. | CO2和SiO2化学键类型相同,晶体类型不同 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| D. | 氯化钠熔化时离子键未被破坏 |
| A. | 非极性分子中不可能有极性键 | |
| B. | 中心原子sp3杂化且无孤电子对的粒子键角都是109°28 | |
| C. | 离子化合物中可能有非极性键 | |
| D. | 正四面体的结构键角都是109°28 |
| A. | 丁烷 | B. | 1,3-丁二烯 | ||
| C. | 乙苯 | D. | 2-甲基-1,3-丁二烯 |
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体吸收利用的太阳能 |
| A. | 氯气的分子式 Cl | B. | 钠原子的结构示意图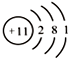 | ||
| C. | N2的电子式:N:::N: | D. | NaCl的电子式 Na+:Cl: |
| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 氢氧化钠溶液 |
