题目内容
5.某兴趣小组为验证SO2和Cl2的漂白性,设计了如下方案,请你参与回答下列问题(尾气处理装置未画出).(1)如图所示,通入干燥的Cl2后,同学们发现甲中红色布条不褪色,乙中红色布条褪色了,说明Cl2本身没有漂白性(填“有”或“没有”),Cl2和水反应的生成物HClO有漂白性(填“有”或“没有”),将乙中的布条取出烘干,发现未变为原来的红色,说明HClO的漂白是不可恢复的(填“可恢复的”或“不可恢复的”).
(2)如图丙所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,停止通气体,加热试管,发现溶液又变为红色,说明SO2的漂白是可恢复的(填“可恢复的”或“不可恢复的”).
(3)你认为不能利用SO2的漂白性来漂泊食品(填“能”或“不能”)
(4)如图丁所示,将干燥的Cl2和SO2按其体积比1:1混合,通入石蕊溶液中,发现石蕊溶液变红,不褪色,原因是它们与水一起反应生成了HCl和 H2SO4.写出对应的化学方程式Cl2+SO2+2H2O=H2SO4+2HCl.

分析 (1)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性,次氯酸漂白为氧化性漂白,具有不可恢复性;
(2)二氧化硫能够与有色物质化合生成无色物质,因而具有漂白性,该无色化合物具有不稳定性,受热容易分解,恢复原来的颜色;
(3)二氧化硫有毒,虽具有漂白性,但不能用来漂白食品;
(4)氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应生成没有漂白性的HCl和H2SO4而使气体失去漂白性.
解答 解:(1)如图所示,通入干燥的Cl2后,同学们发现甲中红色布条不褪色,现象说明氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,乙中红色布条褪色了,现象说明氯气能使湿润的有色布条褪色,是因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,将乙中的布条取出烘干,发现未变为原来的红色,说明HClO的漂白是不可恢复的,为彻底性漂白,
故答案为:没有;有;不可恢复的;
(2)如图丙所示,向品红溶液中通入SO2,同学们发现品红溶液褪色了,说明二氧化硫具有漂白性,原因是二氧化硫与有色物质化合生成无色物质,停止通气体,加热试管,发现溶液又变为红色,说明该无色化合物具有不稳定性,受热容易分解,加热后溶液恢复颜色;
故答案为:可恢复的;
(3)二氧化硫虽然有漂白性,但是有毒,用于食品漂白,会严重损伤人体肝、肾脏等,所以不能用来漂白食品,
故答案为:不能;
(4)HCl和H2SO4没有漂白性,氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,反应方程式为Cl2+SO2+2H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl.
点评 本题考查次氯酸和二氧化硫的漂白性性质实验方案的设计,为高频考点,把握实验装置的作用次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的,其漂白原理不同为解答的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 按系统命名法,化合物  的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. |  与 与 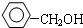 互为 同系物 互为 同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 戊二醛的分子式为C5H8O2,符合此分子式的二元醛有5种 | |
| B. | 1 mol戊二醛与足量的银氨溶液反应,最多可得 2 mol银 | |
| C. | 戊二醛不能使酸性高锰酸钾溶液褪色 | |
| D. | 戊二醛经催化氧化可以得到4种戊二酸 |
| A. | 二次电池的放电与充电属于可逆反应 | |
| B. | 碱金属单质在空气中燃烧都生成过氧化物 | |
| C. | 在周期表中,族序数都等于该族元素的最外层电子数 | |
| D. | 在周期表过渡元素中寻找催化剂恒和耐腐蚀、耐高温的合金材料 |
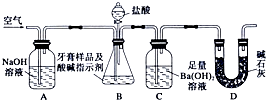 化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究: .
.
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.