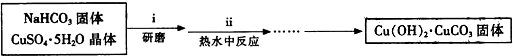
题目内容
13.一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s)?zC(g),达到平衡后测得A气体的浓度为0.5mol•L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3mol•L-1,则下列叙述正确的是( )| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
分析 保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,
A.平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体的物质的量增大,C物质的量减小,故C的体积分数下降,故A正确;
B.增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x>z,所以x+y>z,故B正确;
C.由上述分析可知,平衡向逆反应移动,故C错误;
D.由B分析可知,x+y>z,故D错误;
故选AB.
点评 本题考查了化学平衡的影响因素,题目难度不大,注意掌握化学平衡及其影响因素,明确增大容器容积后平衡移动方向为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
8.已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-Q1kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
由此计算:△H1=kJ/mol.已知△H2=-58kJ/mol,则△H3=kJ/mol.
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
5.一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3=2Al3++3H2O.
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝.
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在.
设计实验证实如下:
| 装置 | 现象 |
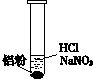 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
1Al+1NO3-+4H+═1Al3++1NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.
重新设计实验证实如下:
| 装置 | 现象 |
 | ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(5)实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.习题中的无色溶液一定能大量存在的是Na+和OH-.
 N和Si是合成新型非金属材料的两种重要元素.请回答:
N和Si是合成新型非金属材料的两种重要元素.请回答: ;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
;Si原子可形成多种氢化物,其中Si2H6中Si原子的价层电子对数目为4.
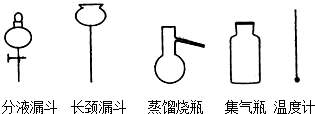

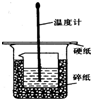 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题: