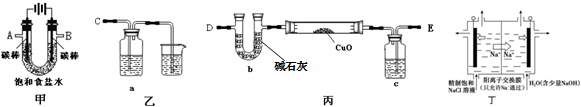
题目内容
3.将硫铁矿和焦炭按物质的量比为3:2,混合放在炼硫炉中,通入适量空气中,发生下列反应:FeS2+C+O2→Fe3O4 +CO+S,请配平上述化学反应方程式:3FeS2+2C+3O2═Fe3O4+2CO+6S.分析 氧化还原反应FeS2+C+O2→Fe3O4+CO+S中,Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2价,依据电子守恒和原子守恒配平
解答 解:Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2,硫铁矿和焦炭按物质的量比为3:2,则3FeS2~Fe3O4~2e-,2C~2CO~4e-,3FeS2~6S~6e-,电子转移总数=2+4+6=12,
氧化还原反应中得失电子数相等,根据O2~2O~4e-可知氧气分子式前系数=$\frac{12}{4}$=3,结合原子守恒配平该反应为:3FeS2+2 C+3O2=Fe3O4+2CO+6S,
故答案为:3FeS2+2C+3O2═Fe3O4+2CO+6S.
点评 本题考查了氧化还原反应的配平,题目难度中等,正确判断元素化合价为解答关键,注意掌握电子守恒在配平氧化还原反应中的应用,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
11.某同学需要用到85mL 1mol/L的NaCl溶液,现需在实验进行配制,填空并请回答下列问题:
(1)配制1mol/L的NaCl溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAED;
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.定容时,继续向容量瓶内小心加水到溶液离刻度线1-2cm,改用胶头滴管逐滴滴加水到凹液面恰好与刻度线相切
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度偏低;
②若定容时俯视刻度线偏高;
③C操作中不小心洒出有溶液偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点重新配制.
(1)配制1mol/L的NaCl溶液
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
A、用30mL水洗涤烧杯内壁和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B、用托盘天平准确称取所需NaCl的质量,将量好的NaCl倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将NaCl沿玻璃棒注入容量瓶中
D、将容量瓶盖紧,振荡,摇匀
E、继续往容量瓶内小心加水,直到溶液凹面恰好与刻度相切
(3)指出本实验的操作错误的地方,并进行更正.定容时,继续向容量瓶内小心加水到溶液离刻度线1-2cm,改用胶头滴管逐滴滴加水到凹液面恰好与刻度线相切
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”):
①若加蒸馏水时不慎超过了刻度偏低;
②若定容时俯视刻度线偏高;
③C操作中不小心洒出有溶液偏低.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线一点点重新配制.
15.已知:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡后,改变下列条件有利于提高SO2转化率的是( )
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
12.硫黄制酸在我国的工业发展进程中具有重要地位,其工业流程示意图如下.已知硫黄的燃烧热△H=-297kJ•mol-1.下列说法正确的是( )


| A. | Ⅱ中主要反应的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1 | |
| B. | Ⅳ中主要反应的化学方程式:2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Ⅳ中使用催化剂可提高化学反应速率和平衡转化率 | |
| D. | Ⅴ中气体a 可以直接排放到大气中 |
13.一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s)?zC(g),达到平衡后测得A气体的浓度为0.5mol•L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3mol•L-1,则下列叙述正确的是( )
| A. | C的体积分数降低 | B. | x+y>z | ||
| C. | 平衡向正反应方向移动 | D. | x+y<z |
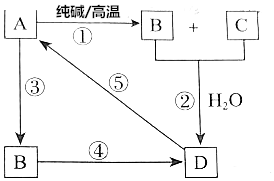 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.