题目内容
15.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时,消耗xmol NH3,则反应达到平衡状态 | |
| C. | 化学反应速率关系是:2v正(NH3)=3v正(H2O) | |
| D. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
分析 A.化学反应速率与化学计量数成正比;
B.表示的都是正反应速率,无法判断平衡状态;
C.由化学方程式可知,水的反应速率较大;
D.增大体积,正逆反应速率都减小.
解答 解:A.化学反应速率与化学计量数成正比,为达到化学平衡时,v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,则4v正(O2)=5v逆(NO),故A正确;
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,表示的都是正反应速率,且不满足计量数关系,无法判断平衡状态,故B错误;
C.化学反应速率关系是:3v正(NH3)=2v正(H2O),故C错误;
D.达到化学平衡时,若增加体积,容器内压强减小,正逆反应速率都减小,故D错误.
故选A.
点评 本题考查化学平衡状态的特征与判断,为高频考点,侧重考查学生的分析能力,注意理解化学平衡状态,选择判断化学平衡的物理量,应随反应进行发生变化,该物理量由“变化”到“不变化”,说明到达平衡,难度不大.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
6.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 1mol Na2O2 固体中含阴阳离子的数目为3NA | |
| D. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L酒精含有的分子数为NA | |
| B. | 500mL lmoL/L的盐酸中含有的HC1分子数为0.5 NA | |
| C. | 2.24LH2含有0.2NA个氢原子 | |
| D. | 通常状况下,71 g Cl2所含原子数为2NA |
20.aR3-和bMn+的核外电子数相等,则a值等于( )
| A. | b+n+3 | B. | b+n-3 | C. | b-n+3 | D. | b-n-3 |
7.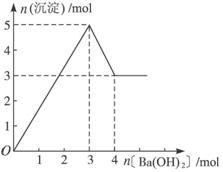 如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
 如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH) 2溶液时,沉淀的物质的量随Ba(OH) 2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO 4 | B. | Al 2(SO 4) 3 | C. | Fe 2(SO 4) 3 | D. | NaAlO 2 |
4.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
| A. | 反应进行30s时,正反应速率等于逆反应速率 | |
| B. | 反应进行80s时,逆反应速率大于正反应速率 | |
| C. | 前60 s,以X浓度变化表示的平均反应速率为0.0005mol/(L•s) | |
| D. | 反应进行80s时,X物质的量浓度为0.04mol/L |