题目内容
7. 实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯.试回答下列各小题:
实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯.试回答下列各小题:(Ⅰ)若用图甲装置进行制备实验,回答下列问题:
(1)A中预先需加入的试剂是Fe或FeBr3,E中需加入的试剂是碱石灰.
(2)仪器B除导气外的作用是冷凝反应物使之回流,进水口为a(选
填字母“a”或“b”).
(Ⅱ)若用图乙装置进行制备实验,回答下列问题:
(1)C中盛放CCl4的作用是吸收HBr中的溴蒸汽;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,写出有关的离子方程式Br2+2OH-=Br-+BrO-+H2O,然后用分液漏斗仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有浅黄色沉淀(填现象)生成,此现象说明这种获得溴苯的反应属于取代反应(填有机反应类型).
分析 Ⅰ、(1)苯与液溴的反应需要催化剂溴化铁,或加入铁粉生成溴化铁使反应进行;E装置是干燥管需要装固体,能吸收生成的溴化氢气体;
(2)反应中苯、溴都是易挥发物质,冷凝管B是导气、冷凝使反应物回流;水流应逆流冷凝效果好;
Ⅱ、(1)挥发出的溴单质易溶在四氯化碳溶液中;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡是吸收过量溴单质溶解于氢氧化钠溶液中和生成的溴苯分层,利用分液漏斗分液得到溴苯;
(3)试管D中吸收的是溴化氢气体,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应;
解答 解:Ⅰ.(1)苯与液溴的反应是需要催化剂溴化铁或铁粉,在催化剂作用下苯和溴发生取代反应生成溴苯和溴化氢;E中需加入的试剂是吸收溴化氢的固体物质碱石灰,
故答案为:Fe或FeBr3;碱石灰;
(2)仪器B除导气外的作用还起到冷凝回流反应物,使反应物充分利用;水逆流冷凝效果好应从a口流入,
故答案为:冷凝反应物使之回流;a;
Ⅱ.(1)溴单质易溶解于四氯化碳中,通过CCl4的作用是吸收溴化氢中的溴单质,故答案为:吸收HBr中的溴蒸汽;
(2)实验结束时,打开A下端的活塞,让反应液流入B氢氧化钠溶液中,吸收溴单质,发生反应的离子反应式为Br2+2OH-=Br-+BrO-+H2O,经充分振荡静置分层,利用分液漏斗分液分离出溴苯,
故答案为:Br2+2OH-=Br-+BrO-+H2O;分液漏斗;
(3)试管D中吸收的是溴化氢气体,生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应,
故答案为:浅黄色沉淀;取代.
点评 本题考查了物质性质的实验验证和制取方案的设计,装置分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
1.向含有下列离子的溶液中分别加入烧碱固体(溶液的体积变化可忽略),能引起下列离子浓度增大的是( )
| A. | HCO3- | B. | Cl- | C. | OH- | D. | Cu2+ |
2.芳香醛A( )有多种同分异构体,其中分子中含苯环和羧基的同分异构体共有( )
)有多种同分异构体,其中分子中含苯环和羧基的同分异构体共有( )
 )有多种同分异构体,其中分子中含苯环和羧基的同分异构体共有( )
)有多种同分异构体,其中分子中含苯环和羧基的同分异构体共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.下列物质既不能与甲烷反应,也不能与乙烯反应的是( )
| A. | 氯气 | B. | 溴水 | ||
| C. | 二氧化碳 | D. | 酸性高锰酸钾溶液 |
17.太阳能是一种应用广泛的绿色能源.如图是太阳能电池经太阳光照射前和太阳光照射时内部电子的变化情况.图乙中灯泡变亮.关于该过程的描述正确的是( )


| A. | 该过程光能变为化学能再变为电能 | B. | 太阳能电池可以用高纯硅制造 | ||
| C. | N为电子流入的一极 | D. | 用该电池精炼铜时粗铜与N极连接 |
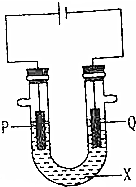 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.

 氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题:
氮磷砷锑铋位于周期表第ⅤA族,它们的单质及其化合物在社会生产生活中有广泛应用,请回答有关问题: .
. ,X属于共价化合物.Y的电子式是
,X属于共价化合物.Y的电子式是 ,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键.
,Y属于离子化合物.Y中含有的化学键类型有离子键、共价键. .
.