题目内容
19.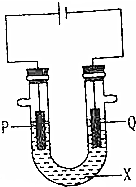 为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.
为探究工业生产氯气的原理,某同学设计了如图的实验装置,其中U型管中装有物质X,并乙滴入几滴酚酞试液,P,Q两根石墨棒作为电极,通过导线与直流电源相连.请回答以下问题.(1)物质X是NaCl溶液.
(2)电解时,Q电极上产生无色气体,检验该气体的方法是:收集一试管气体,放在酒精灯上点燃,如果产生噗噗的声音,证明产生的是氢气.
P电极上产生黄绿色气体,该气体是Cl2;检验该气体的方法是用湿润的淀粉碘化钾试纸放在导管口,若试纸变蓝色,证明产生的气体是氯气,此外,溶液中还能观察到溶液变为红色.
分析 电解饱和食盐水时,阳极上是氯离子失电子得到氯气,阴极上是氢离子得电子产生氢气,以此解答该题
解答 解:(1)电解饱和食盐水可以获得氯气,所以X是氯化钠溶液,故答案为:NaCl溶液;
(2)和电源的负极相连的电极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,氢气的检验方法:收集一试管气体,放在酒精灯上点燃,如果产生噗噗的声音,证明产生的是氢气;和电源的正极相连的电极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,氯气可用淀粉碘化钾试纸检验,可使试纸变蓝色,并且在阴极负极氢离子浓度减小,氢氧根离子浓度增加,所以溶液碱性增强,遇到酚酞溶液显示红色.
故答案为:收集一试管气体,放在酒精灯上点燃,如果产生噗噗的声音,证明产生的是氢气;Cl2;用湿润的淀粉碘化钾试纸放在导管口,若试纸变蓝色,证明产生的气体是氯气;溶液变为红色.
点评 本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
相关题目
9.甲乙两烧杯中各盛有300mL 1mol/L盐酸和氢氧化钠,向两烧杯中分别加入等质量的铝粉.反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉质量为( )
| A. | 5.4g | B. | 3.6g | C. | 2.7g | D. | 1.8g |
10.下列关于物质性质或检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过湿润的蓝色石蕊试纸,试纸变红,证明原气体中含有氨气 | |
| C. | 用铂丝灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,可能有K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
7.下列物质中所含原子数最多的是( )
| A. | 6.02×1023个N2 | B. | 9g H2O | C. | 0.5mol Br2 | D. | 10g H2 |
14.25℃时,浓度均为0.1mol•L-1的NaA和NaB溶液的pH分别为8和12,下列说法正确的是( )
| A. | NaA溶液中水的电离程度比NaB溶液中水的电离程度大 | |
| B. | 在NaA溶液中:c(Na+)-c(A-)=10-8mol•L-1 | |
| C. | 将两溶液等体积混合,混合溶液的pH约为10 | |
| D. | 在NaB溶液中:c(H+)+c(HB)=10-2mol•L-1 |
4.Mg、Al、Fe分别与足量的HC1反应,产生的气体在相同状况下,均是5.6升,则Mg、Al、Fe三种金属物质的量比为( )
| A. | 3:2:2 | B. | 2:3:2 | C. | 2:2:3 | D. | 3:2:3 |
4.下列反应需要加入还原剂才能实现的是( )
| A. | MnO4-→Mn2+ | B. | Cl-→Cl2 | C. | HCO3-→CO2 | D. | PCl5→H3PO4 |
5.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | (NH4)2Fe(SO4)2溶液中:Ba2+、K+、OH-、Br- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-12的溶液中:NH4+、Cu2+、NO3-、Cl- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe3+、ClO-、SO42- |
 实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯.试回答下列各小题:
实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯.试回答下列各小题: