题目内容
9.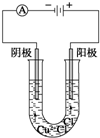 按如图所示装置进行探究实验:电解CuCl2溶液
按如图所示装置进行探究实验:电解CuCl2溶液(1)实验现象:
阴极:石墨棒上逐渐覆盖了一层Cu;
阳极:石墨棒上有气体产生,湿润的KI淀粉试纸变成蓝色.
(2)电解过程分析:
通电前:CuCl2在水溶液中电离,电离方程式:CuCl2=Cu2++2Cl-,
通电时:Cu2+趋向阴极(填“阳”或“阴”)
电极反应式:阳极:2Cl--2e-=Cl2↑,
电解的总方程式:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++Cl2↑.
分析 (1)电解CuCl2溶液,阴极:发生还原反应生成铜,电极方程式为Cu2++2e-=Cu;阳极:发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,氯气能使湿润的KI淀粉试纸变蓝,以此解答该题;
(2)书写电离方程式首先应分清电解质的强弱,强电解质完全电离,弱电解质分步电离,多元弱酸分步电离,多元弱酸的酸式根离子不能拆.
解答 解:(1)电解CuCl2溶液,阴极:发生还原反应生成铜,电极方程式为Cu2++2e-=Cu;阳极:发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,氯气能使湿润的KI淀粉试纸变蓝,
故答案为:Cu;气体;蓝色;
(2)氯化铜为强电解质,完全电离,电离方程式为:CuCl2=Cu2++2Cl-,通电时,Cu2+趋向阴极,阳极:发生氧化反应生成氯气,电极方程式为2Cl--2e-=Cl2↑,电解总方程式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++Cl2↑,
故答案为:CuCl2=Cu2++2Cl-;阴;2Cl--2e-=Cl2↑;CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++Cl2↑.
点评 本题考查了电解池的基本原理及电极反应式的书写及现象分析,明确电解池的基本原理是关键,题目难度不大.

练习册系列答案
相关题目
4.向体积相同的A、B、C、D四个密闭容器中分别充入一定量的SO2和O2.开始反应时,反应最快的容器序号是( )
| 选项 | 温度 | 物质的量 | 催化剂 |
| A | 400℃ | 8mol SO2和5mol O2 | 无 |
| B | 400℃ | 10mol SO2和5mol O2 | 无 |
| C | 450℃ | 10mol SO2和5mol O2 | V2O5作催化剂 |
| D | 450℃ | 8mol SO2和5mol O2 | 无 |
| A. | A | B. | B | C. | C | D. | D |
5.下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是( )
| A. | 甲苯 | B. | 乙烷 | C. | 丙烯 | D. | 乙烯 |
17. 常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
 常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )| A. | a点:c(CO32-)>c(HCO3-)>c(Cl-) | B. | b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
1.A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法不正确的是( )
| A. | 原子半径:C>D>A>B | |
| B. | A、C、D元素最高价氧化物的水化物间相互反应 | |
| C. | C、D、A、B四种元素的最高价化合价依次升高 | |
| D. | B元素在周期表中的位置为第二周第ⅥA族 |
18.不能将有机物鉴别开来的一组是( )
| A. | 用在空气中点燃的方法鉴别甲烷、乙烯和乙炔 | |
| B. | 用新制的氢氧化铜悬浊液鉴别乙酸、乙醇和乙醛三种液体 | |
| C. | 用酸性高锰酸钾溶液鉴别苯甲醇、苯酚、醛甲醛三种溶液 | |
| D. | 用溴水鉴别已烯、四氯化碳、乙苯三种溶液体 |
19.已知短周期元素的离子,A2+,B+,C3-,D-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径A>B>D>C | B. | 原子序数D>C>B>A | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 单质的还原性A>B>D>C |
 的合成路线(其他无机试剂任选).已知
的合成路线(其他无机试剂任选).已知 .
.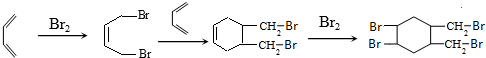 .
.