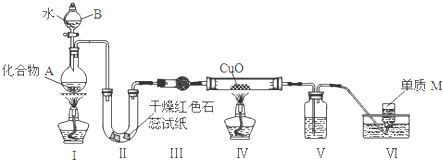
题目内容
18.某化学小组为测定一定质量的某镁铝混合物中镁、铝的质量分数,设计了如下实验方案:取ag镁铝混合物$→_{充分反应}^{足量溶液B}$测定剩余固体的质量为bg
当溶液B为NOH溶液时,铝的质量分数为$\frac{a-b}{a}$×100%.
分析 铝与氢氧化钠反应,而镁不反应,所以测定剩余固体的质量为bg是镁的质量,则铝的质量为(a-b)g,根据铝的质量分数为$\frac{铝的质量}{合金的质量}×100%$.
解答 解:铝与氢氧化钠反应,而镁不反应,所以测定剩余固体的质量为bg是镁的质量,则铝的质量为(a-b)g,所以铝的质量分数为$\frac{铝的质量}{合金的质量}×100%$=$\frac{a-b}{a}$×100%,故答案为:$\frac{a-b}{a}$×100%.
点评 本题主要考查中元素的质量分数和元素的质量比,根据铝与氢氧化钠反应,而镁不反应,应用质量差进行计算求解.

练习册系列答案
相关题目
6.有以下四种微粒14N、15N、N2、N4(结构为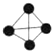 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
13.几种短周期元素的原子半径及主要化合价如表( )
下列叙述错误的是(其中NA表示阿伏加德罗常数的值)
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A. | X、N元素的金属性:X>N | |
| B. | Y、M元素形成的离子化合物是工业冶炼Y的原料 | |
| C. | X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 | |
| D. | 表中Z元素的最高价氧化物的水化物的分子式可表示为H3ZO4 |
10.下列物质性质的比较中,正确的是( )
| A. | 氢化物稳定性:HBr>HCl>PH3 | B. | 离子半径:Na+>Cl->F- | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 离子的还原性 Cl>Br>I |
7.对化学反应限度的叙述错误的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应达到限度时,各物质的浓度不再改变 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
8.下列实验能获得成功的是( )
| A. | 制取溴苯:铁屑、溴水、苯 | |
| B. | 要检验卤代烃中的卤素原子,可向其溶液中加入AgNO3溶液 | |
| C. | 苯酚有酸性,可使紫色石蕊变红 | |
| D. | 用溴水可鉴别苯、CCl4、苯乙烯 |
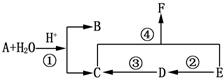
 .
.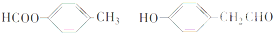 ;
; 和
和 (写结构简式)
(写结构简式)