题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |
考点:离子共存问题
专题:离子反应专题
分析:A.能与Cu反应产生气体的溶液具有强氧化性,亚铁离子具有还原性,能够被氧化成铁离子;
B.滴入甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性溶液中具有强氧化性,能够氧化碘离子;
C.由水电离出的C(H+)?C(OH-)═10-24溶液,该溶液抑制了水的电离,溶液可能为酸性或者碱性溶液,K+、Na+、NO3-、Cl-之间不反应,也不与氢离子和氢氧根离子反应;
D.Al3+、ClO-之间能够发生反应,在溶液中不能大量共存.
B.滴入甲基橙显红色的溶液为酸性溶液,硝酸根离子在酸性溶液中具有强氧化性,能够氧化碘离子;
C.由水电离出的C(H+)?C(OH-)═10-24溶液,该溶液抑制了水的电离,溶液可能为酸性或者碱性溶液,K+、Na+、NO3-、Cl-之间不反应,也不与氢离子和氢氧根离子反应;
D.Al3+、ClO-之间能够发生反应,在溶液中不能大量共存.
解答:
解:A.该溶液具有强氧化性,Fe2+具有较强还原性,能够在该溶液中被氧化成铁离子,无法在溶液中大量共存,故A错误;
B.该溶液为酸性溶液,NO3-在酸性条件下能够氧化I-,在溶液中不能大量共存,故B错误;
C.该溶液为酸性或者碱性溶液,K+、Na+、NO3-、Cl-之间不发生反应,也不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.由于Al3+、ClO-之间能够反应,在溶液中不能大量共存,故D错误;
故选C.
B.该溶液为酸性溶液,NO3-在酸性条件下能够氧化I-,在溶液中不能大量共存,故B错误;
C.该溶液为酸性或者碱性溶液,K+、Na+、NO3-、Cl-之间不发生反应,也不与氢离子和氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.由于Al3+、ClO-之间能够反应,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.

练习册系列答案
相关题目
下列溶液中,各组离子能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、K+、SO42- |
下列对应关系不正确的是( )
| A、醋、味精--调味品 |
| B、酒精、汽油--易燃液体 |
| C、Na+、Fe3+--人体所需微量元素 |
| D、废塑料瓶、铝制易拉罐--可回收垃圾 |
下列说法中,不正确的是( )
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
下列说法正确的是( )
| A、钙和氮均为人体所需的微量元素 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、油脂和蛋白质均属于高分子化合物 |
| D、明矾与水作用能生成有吸附性的物质 |
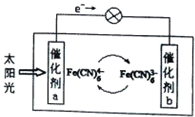 一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理示意图如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A、K+移向催化剂b |
| B、催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63- |
| C、Fe(CN)63-在催化剂b表面被氧化 |
| D、电解质溶液中Fe(CN)63-和Fe(CN)64-浓度基本保持不变 |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: