题目内容
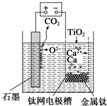 如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )| A、阳极反应式为C+2O2--4e-═CO2↑ |
| B、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| C、制备金属钛前后,装置中CaO的量不变 |
| D、TiO2在阴极放电 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据图知,阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2
Ti+2CaO,“+”接线柱应连接原电池正极.
| ||
解答:
解:A.阳极上电极反应式为C+2O2--4e-═CO2↑,阴极上电极反应式为2Ca2++4e-═2Ca,故A正确;
B.阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO等,则由TiO2制得1mol金属Ti,理论上外电路转移4mol电子,故B正确;
C.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2
Ti+2CaO,所以CaO质量不变,故C正确;
D.TiO2与Ca反应,不参与电极放电,故D错误.
故选D.
B.阴极的电极反应式为2Ca2++4e-═2Ca、2Ca+TiO2=Ti+2CaO等,则由TiO2制得1mol金属Ti,理论上外电路转移4mol电子,故B正确;
C.阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2
| ||
D.TiO2与Ca反应,不参与电极放电,故D错误.
故选D.
点评:本题综合考查电解池和原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,难度中等.

练习册系列答案
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3+Cu═2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g.(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.下列关于原废液组成的判断正确的是( )
| A、一定含有Fe2+、Fe3+、Cu2+、Cl- |
| B、c(Fe2+):c(Cu2+)=2:1 |
| C、c(Fe2+):c(Fe3+)=3:1 |
| D、c(Cl-)=6mol/L,c(Fe2+)=0.6mol/L |
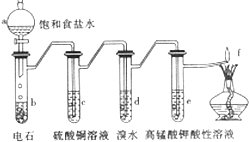 如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )
如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )| A、制备乙炔的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑ |
| B、c的作用是除去影响后续实验的杂质 |
| C、d中的有机产物与AgNO3溶液混合能产生沉淀 |
| D、e中的现象说明乙炔能被高锰酸钾酸性溶液氧化 |
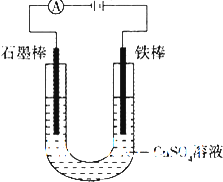 如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )
如图装置,U形管中装有50mL 2mol?L-1的CuSO4溶液.通电一段时间后,下列说法正确的是( )| A、转移0.2 mol电子时,阳极减少质量大于阴极增加质量 |
| B、转移0.4 mol电子时,阴极得到2.24 L标准状况下的气体 |
| C、电解一段时间后,U形管中会产生红褐色物质,后来逐渐溶解 |
| D、若将石墨棒换成铜棒,可实现铁制品上镀铜 |
室温下,有pH均为9体积均为10mL的NaOH溶液和CH3COONa溶液,下列说法正确的是( )
| A、两种溶液中的c(Na+)相等 | ||
B、两溶液中由水电离出的c(OH-)之比为
| ||
| C、分别加水稀释到100mL时,两种溶液的pH依然相等 | ||
| D、分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等 |
下列说法正确的是( )
| A、钙和氮均为人体所需的微量元素 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、油脂和蛋白质均属于高分子化合物 |
| D、明矾与水作用能生成有吸附性的物质 |