题目内容
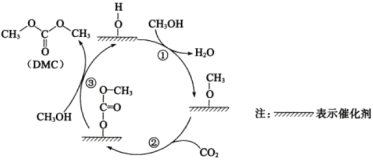
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
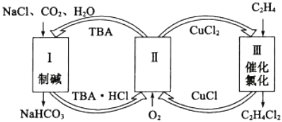
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.过程Ⅲ中的反应方程式为C2H4+2CuCl2![]() C2H4C12+2CuC1
C2H4C12+2CuC1
D.理论上每生成1 mol NaHCO3,可得到1 mol C2H4C12
【答案】D
【解析】
A.侯德榜制碱法是先把氨气通入食盐水,然后向氨化的食盐水中通二氧化碳气体,生产溶解度较小的碳酸氢钠,再将碳酸氢钠过滤出来,经焙烧得到纯净洁白的碳酸钠,由图可知,过程I中的TBA替代了侯德榜制碱法中的氨气,A正确;
B.过程Ⅱ为TBA的再生过程为![]() O2+2CuCl+2TBAHCl=2CuCl2+2TBA+2H2O,实现了TBA、CuCl2的再生,B正确;
O2+2CuCl+2TBAHCl=2CuCl2+2TBA+2H2O,实现了TBA、CuCl2的再生,B正确;
C.过程Ⅲ是乙烯的氯化过程,化学方程式为C2H4+2CuCl2![]() C2H4Cl2+2CuCl,C正确,
C2H4Cl2+2CuCl,C正确,
D.制碱过程为NaCl+CO2+H2O+TBA=NaHCO3+TBAHCl,理论上每生成1 mol NaHCO3,需要1 moI TBA,根据关系式TBA~CuCl~0.5 mol C2H4Cl2,因此理论上每生成1 mol NaHCO3,可得到0.5 mol C2H4C12,D错误;
故合理选项是D。

【题目】CO在工农业生产及科学研究中有着重要的应用。
(1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为__________。
(2)CO催化脱氮:在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化制作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
时间 浓度 | 0 min | 5 min | 10 min | 15 min | 20 min |
c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5 min内NO2的转化率将_____(填“变大”“变小”或“不变”)。
②下列表述能说明该反应已达到平衡状态的是______(填序号)。
A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是_____(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的![]() 。则:
。则:
①0~10 min内平均反应速率v(Ni)=___g·min-1。
②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的![]() =__。
=__。
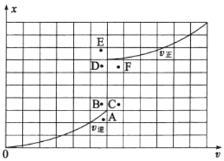
③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为_______、_______(填字母)。
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是__。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留两位小数)。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____。
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
⑤如图是某次滴定时的滴定管中的液面,其读数为__________mL。

【题目】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___,Zn的基态原子能级最高的电子的电子云轮廓图形状为___。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___mol,其阴离子中心原子的杂化方式是___,NH3的沸点高于PH3的原因是___。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
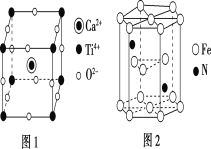
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm-3(列出计算式即可)。