题目内容
【题目】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___,Zn的基态原子能级最高的电子的电子云轮廓图形状为___。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___mol,其阴离子中心原子的杂化方式是___,NH3的沸点高于PH3的原因是___。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___。
(5)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
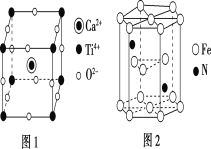
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xcm,高为ycm,NA为阿伏加德罗常数的值,则晶胞的密度为___g·cm-3(列出计算式即可)。
【答案】[Ar]3d6 球型 Mg 的电子排布式为[Ne]3s2 ,Al 的电子排布式为[Ne]3s2 3p1 ,镁的 3s 处于全满状态,较稳定不易失去一个电子,铝的最外层为3p1 ,易失去一个电子形成稳定结构 24 sp3 氨分子之间形成分子间氢键 3d 轨道上没有未成对电子(或 3d 轨道全空或全满状态) ![]() 4
4 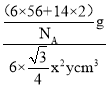
【解析】
(1)铁为26号元素,基态原子电子排布式为[Ar]3d6 4s2,所以Fe2+电子排布式为[Ar]3d6;Zn为30号元素,基态原子能级最高的电子为4s上的2个电子,所有电子云轮廓图形状为球形,故答案为:[Ar]3d6 球形;
(2)Mg的电子排布式为[Ne]3s2,Al的电子排布式为[Ne]3s2 3p1,镁的3s处于全满状态,较稳定,不易失去一个电子,铝的最外层为 3p1,易失去一个电子形成稳定结构,所以 Al 原子的第一电离能比Mg大,故答案为:Mg 的电子排布式为[Ne]3s2 ,Al 的电子排布式为[Ne]3s2 3p1,镁的3s处于全满状态,较稳定不易失去一个电子,铝的最外层为3p1 ,易失去一个电子形成稳定结构;
(3)[Zn(NH3)6] 2+中每个N原子形成3个氮氢σ键,与Zn2+形成1个配位键,配位键也属于σ键,所以1mol该离子中σ键为24 mol;阴离子为![]() ,根据价层电子对互斥理论,其中心原子S的价电子对为
,根据价层电子对互斥理论,其中心原子S的价电子对为![]() 对,所以中心S为sp 3杂化。NH3分子中 N原子的电负性强,原子半径小,使得N—H键的极性增强而表现一定的电性,分子之间能够形成氢键,而PH3分子中P半径大,电负性小,则不能形成分子间氢键,只存在范德华力,氢键的作用力强于范德华力,所以沸点NH3大于PH3,故答案为:24 sp 3 氨分子之间形成分子间氢键;
对,所以中心S为sp 3杂化。NH3分子中 N原子的电负性强,原子半径小,使得N—H键的极性增强而表现一定的电性,分子之间能够形成氢键,而PH3分子中P半径大,电负性小,则不能形成分子间氢键,只存在范德华力,氢键的作用力强于范德华力,所以沸点NH3大于PH3,故答案为:24 sp 3 氨分子之间形成分子间氢键;
(4)Sc3+的外围电子排布式为[Ar]3d0 、Cr3+的外围电子排布式为[Ar]3d3 、Fe2+电子排布式为 [Ar]3d6 、Zn2+的外围电子排布式为[Ar]3d10,对比四种离子的外围电子排布式可知,其水合离子的颜色与3d轨道上的单电子有关,故答案为:3d 轨道上没有未成对电子(或 3d 轨道全空或全满状态);
(5)Fe能够提供空轨道,而Cl能够提供孤电子对,故 FeCl3分子双聚时可形成配位键。由常见AlCl3的双聚分子的结构可知FeCl3的双聚分子的结构式为![]() ,其中 Fe的配位数为4,故答案为:
,其中 Fe的配位数为4,故答案为:![]() 4 ;
4 ;
(6)由图示,堆积方式为六方最紧密堆积。为了计算的方便,选取该六棱柱结构进行计算:六棱柱顶点的原子是6个六棱柱共用的,面心是两个六棱柱共用,所以该六棱柱中的铁原子为 ![]() 个,N原子位于六棱柱内部,所以该六棱柱中的氮原子为2个,该结构的质量为
个,N原子位于六棱柱内部,所以该六棱柱中的氮原子为2个,该结构的质量为![]() ,该六棱柱的底面为正六边形,边长为x cm,底面的面积为6个边长为x cm 的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为
,该六棱柱的底面为正六边形,边长为x cm,底面的面积为6个边长为x cm 的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为 ![]() cm2 ,高为 y cm,所以体积为
cm2 ,高为 y cm,所以体积为![]() cm3。所以密度为:
cm3。所以密度为: 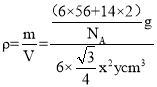 ,故答案为:
,故答案为: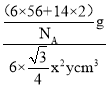 。
。

【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D