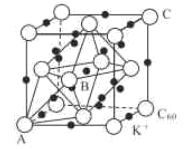
��Ŀ����
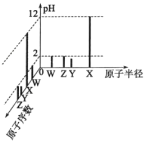
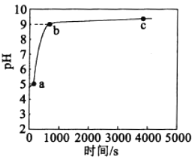
����Ŀ�������£���1 mol��L-1NH4C1��Һ�м���������þ��������ϵpH��ʱ��仯��������ͼ��ʾ��ʵ��۲쵽b�㿪ʼ��Һ���а�ɫ�������ɡ�����˵��������ǣ� ��(��֪Ksp[Mg(OH)2]=1.8��10-11)
A.a����Һ�У�c(NH4+)+c(H+)��c(C1-)+c(OH-)
B.b��ʱ����Һ��c(Mg2+)=0.18 mol��L-1
C.��ϵ�У�ˮ�ĵ���̶ȴ�С��ϵΪa��c��b
D.�����£�NH4C1��ˮ��ƽ�ⳣ��������Ϊ10-10
���𰸡�C
��������
A��a����Һ�ĵ���غ�Ϊ��c(NH4+)+c(H+)+2c(Mg2+)=c(Cl-)+c(OH-)������c(NH4+)+ c(H+)��c(Cl-)+c(OH-)��A��ȷ��
B��b��ʱ��Ksp[Mg(OH)2]=1.8��10-11����ͼ��֪b��ʱpH=9����c(H+)=10-9 mol/L��c(OH-)=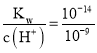 mol/L=10-5 mol/L������c(Mg2+)=
mol/L=10-5 mol/L������c(Mg2+)= mol/L=0.18 mol/L��B��ȷ��
mol/L=0.18 mol/L��B��ȷ��
C����NH4+ˮ�⣺NH4++H2ONH3H2O+H+������þ����������Һ�е�H+��ʹƽ�������ƶ����ٽ���NH4+��ˮ�⣬ͬʱ�ٽ���ˮ�ĵ��룬����ˮ�ĵ���̶ȴ�С��ϵΪ��c��b��a��C����
D��NH4Cl�е�NH4+ˮ�⣺NH4++H2ONH3H2O+H+����Kh=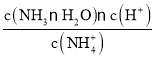 ����NH4+ˮ��ķ���ʽ�ó���c(NH3H2O)��c(H+)����������ͼ��û����þ֮ǰ��Һ��pH=5����c(NH3H2O)��c(H+)=10-5 mol/L����Kh=10-10������ˮ��ƽ�ⳣ����������Ϊ10-10��D��ȷ��
����NH4+ˮ��ķ���ʽ�ó���c(NH3H2O)��c(H+)����������ͼ��û����þ֮ǰ��Һ��pH=5����c(NH3H2O)��c(H+)=10-5 mol/L����Kh=10-10������ˮ��ƽ�ⳣ����������Ϊ10-10��D��ȷ��
�ʺ���ѡ����C��

 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�����Ŀ���Ȼ���������Ҫ�Ļ�ԭ���������ڼ�����������ۺ��Ȼ��������������Ʊ�FeCl2�ķ����ж��֡���ش��������⣺
��.�ᾧ����ȡFeCl2
��һ��Ũ�ȵ������У������������м����ַ�Ӧ�����������־�Ĥ��____��______����Һ���룬ϴ�ӣ����ٸ����Ƶá�
��.�ȱ���ԭ��ˮFeC13��ȡFeC12
��ˮFeCl3���ȱ���Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl��
2FeCl2+C6H4Cl2+HCl��
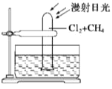
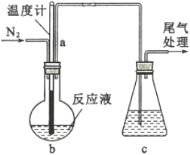
(1)��ͼ���ø����C12��������ȡ��ˮFeC13��װ�á�Ӳ�ʲ����ܺ��ռ����ô�ڹ����ӵ�ԭ����________��
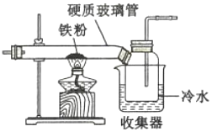
(2)������ͼװ���Ʊ���ˮFeC12�������FeC13��ת���ʡ���֪������ʵIJ����������£�
C6H5C1(�ȱ�) | C6H4C12 | FeC13 | FeC12 | |
��Է������� | 112.5 | 147 | 162.5 | 127 |
�۵�/�� | -45 | 53 | 306 | 670~674 |
�е�/�� | 132 | 173 | 315 | 1023 |
��162.5 g��ˮ�Ȼ�����200 g�ȱ����뵽Բ����ƿ�У�����ƿ�м���200 g���з�̪��9.5%��NaOH��Һ����ͨ��N2һ��ʱ�䣬�ټ��ȣ������¶���132 �����ҷ�����Ӧ��ʵ����ɺ���ȴ�������ᴿ�õ��ֲ�Ʒ��
����ͨ��N2��Ŀ����_______������a��������______��
�ڵ���ƿ����Һ��ɫ�ɺ�ɫ��Ϊ��ɫʱ��ֹͣ���ȣ����Ȼ���ת���������ϴﵽ��______%��
��ʵ��������չ����ȱ��IJ�������Ϊ______��
��ָ��װ��c���ܴ��ڵ�ȱ��______��