题目内容
有A、B、C、D 4种元素.A的最高正价与其负价的绝对值之差为6,A、D次外电子层都是8个电子;A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子.B有两个电子层,其最高正价与最低负价的代数和为零.C2-离子与氖原子具有相同的电子层结构.试写出上述各元素的符号:A ,B ,C ,D .
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A的最高正价与其负价的绝对值之差为6,则A的最高正价为+7价,最低负价为-1价,A、D次外电子层都是8个电子,则A、D为第三或第四周期元素,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,则A在第三周期的后面,可形成阴离子,D在第四周期的前面,可形成阳离子,由此可确定A、D元素种类;B有两个电子层,其最高正价与最低负价的代数和为零,则说明B在第二周期,最外层有4个电子,据此确定B元素的种类;C2-离子与氖原子具有相同的电子层结构,则可知C原子核外有8个电子,据此确定C元素的种类.
解答:
解:A的最高正价与其负价的绝对值之差为6,则A的最高正价为+7价,最低负价为-1价,A、D次外电子层都是8个电子,则A、D为第三或第四周期元素,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,则A在第三周期的后面,可形成阴离子,D在第四周期的前面,可形成阳离子,由此可确定A为氯元素、D为钾元素;B有两个电子层,其最高正价与最低负价的代数和为零,则说明B在第二周期,最外层有4个电子,所以B为碳元素;C2-离子与氖原子具有相同的电子层结构,则可知C原子核外有8个电子,所以C为氧元素,
故答案为:Cl;C;O;K.
故答案为:Cl;C;O;K.
点评:本题主要考查了根据原子核外电子排布的特征和化合价的特点推断元素种类,难度不大,解题时要熟悉常见元素原子核外电子排布情况.

练习册系列答案
相关题目
 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X(?),该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X(?),该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
下列各组离子中电子层结构相同的是( )
| A、S2-、Cl-、K+ |
| B、Na+、Cl-、Mg2+ |
| C、Cl-、Mg2+、Al3+ |
| D、Li+、O2-、F- |
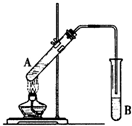 在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯. 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: 在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题: