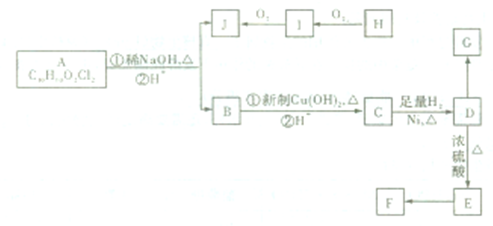
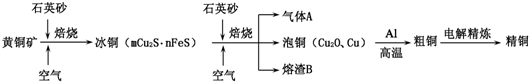
题目内容
根据所学的核外电子排布原则,写出核电荷数分别为19的K、24的Cr、26的Fe以及29的Cu原子的电子排布,并指出在第五周期中与上述元素有相同价电子排布的相应原子核电荷数.
考点:原子核外电子排布
专题:原子组成与结构专题
分析:核电荷数=原子核外电子数,根据构造原理、泡利原理、洪特规则写出电子排布式,第五周期中与上述元素有相同价电子排布的相应原子核电荷数相差18.
解答:
解:①K的原子核外电子数为19,原子核外电子排布式为1s2 2s22p6 3s23p6 4s1,第五周期中与K有相同价电子排布的相应原子核电荷数=19+18=37;
②Cr的原子核外电子数为24,其中3d5处于半满时具有较低的能量,原子核外电子排布式为1s2 2s22p6 3s23p63d5 4s1,第五周期中与K有相同价电子排布的相应原子核电荷数=24+18=42;
③Fe的原子核外电子数为26,原子核外电子排布式为1s2 2s22p6 3s23p63d6 4s2,第五周期没有与Fe电子排布的元素;
④Cu的原子核外电子数为29,其中3d10处于全满时具有较低的能量,原子核外电子排布式为1s2 2s22p6 3s23p63d104s1,第五周期中与K有相同价电子排布的相应原子核电荷数=29+18=47;
答:K:1s2 2s22p6 3s23p6 4s1,第五周期中相对应元素核电荷数为37;
Cr:1s2 2s22p6 3s23p63d5 4s1,第五周期中相对应元素核电荷数为42;
Fe:1s2 2s22p6 3s23p63d6 4s2,第五周期没有与Fe电子排布的元素;
Cu:1s2 2s22p6 3s23p63d104s1,第五周期中相对应元素核电荷数为47.
②Cr的原子核外电子数为24,其中3d5处于半满时具有较低的能量,原子核外电子排布式为1s2 2s22p6 3s23p63d5 4s1,第五周期中与K有相同价电子排布的相应原子核电荷数=24+18=42;
③Fe的原子核外电子数为26,原子核外电子排布式为1s2 2s22p6 3s23p63d6 4s2,第五周期没有与Fe电子排布的元素;
④Cu的原子核外电子数为29,其中3d10处于全满时具有较低的能量,原子核外电子排布式为1s2 2s22p6 3s23p63d104s1,第五周期中与K有相同价电子排布的相应原子核电荷数=29+18=47;
答:K:1s2 2s22p6 3s23p6 4s1,第五周期中相对应元素核电荷数为37;
Cr:1s2 2s22p6 3s23p63d5 4s1,第五周期中相对应元素核电荷数为42;
Fe:1s2 2s22p6 3s23p63d6 4s2,第五周期没有与Fe电子排布的元素;
Cu:1s2 2s22p6 3s23p63d104s1,第五周期中相对应元素核电荷数为47.
点评:本题考查了原子核外电子排布式的书写,难度不大,掌握原子核外电子排布规则是解题的关键,注意洪特规则特例是考查的热点.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列有关实验操作或装置正确的是( )


| A、用图1所示装置进行乙酸乙酯水解 |
| B、用图2所示装置实验室制取乙烯 |
| C、碘水用CCl4萃取分液后再蒸馏,可得到I2 |
| D、梨形分液漏斗检漏,加水后玻璃旋塞处是否漏水即可 |
核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
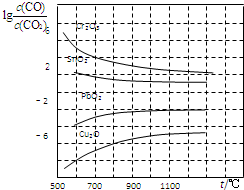 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.