题目内容
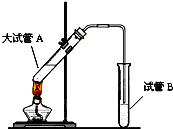
 在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)如图试管中的盛放的是
(2)写出实验室制取乙酸乙酯的化学反应方程式
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态.下列能说明该反应已达到化学平衡状态的有(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等; ⑤混合物中各物质的浓度不再变化.
考点:乙酸乙酯的制取
专题:有机物的化学性质及推断
分析:(1)右侧试管中吸收乙酸乙酯的溶液为饱和碳酸钠溶液;导管下端插入液面以下会发生倒吸现象;
(2)盐酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯,该反应为酯化反应,也属于取代反应;
(3)酯化反应为可逆反应,该反应达到平衡状态时一定满足正逆反应速率相等、各组分的浓度不变,据此对各选项进行判断.
(2)盐酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯,该反应为酯化反应,也属于取代反应;
(3)酯化反应为可逆反应,该反应达到平衡状态时一定满足正逆反应速率相等、各组分的浓度不变,据此对各选项进行判断.
解答:
解:(1)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
导气管的下端不能插入液面以下,否则容易发生倒吸现象,所以目的是防止倒吸,
故答案为:饱和碳酸钠溶液;防止倒吸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,该反应为酯化反应,也是取代反应,
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;酯化反应(或取代反应);
(3)①化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间里,生成1mol乙酸乙酯,同时生成1mol水,故①错误;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;
③表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明达到平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,说明达到平衡状态,故⑤正确;
故答案为:②④⑤.
导气管的下端不能插入液面以下,否则容易发生倒吸现象,所以目的是防止倒吸,
故答案为:饱和碳酸钠溶液;防止倒吸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH
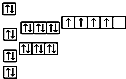
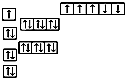
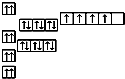
| 浓硫酸 |
| △ |
故答案为:CH3COOH+C2H5OH
| 浓硫酸 |
| △ |
(3)①化学反应速率之比等于化学计量数之比,无论是否达到平衡状态,都存在单位时间里,生成1mol乙酸乙酯,同时生成1mol水,故①错误;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;
③表示的都是正反应速率,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明达到平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,说明达到平衡状态,故⑤正确;
故答案为:②④⑤.
点评:本题考查了乙酸乙酯的制取方法、化学平衡状态的判断,题目难度中等,注意掌握酯化反应原理及实验操作方法方法,明确化学平衡状态的特征及判断方法.

练习册系列答案
相关题目
 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题: