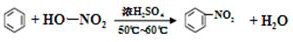题目内容
8.能正确表示下列反应的离子方程式是( )| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+═2Fe3++3H2↑ |
分析 A.一水合氨要写成化学式;
B.氢氧化钙要写成离子形式;
C.向NaHCO3溶液中加入少量的澄清石灰水,生成碳酸钙和碳酸钠、水;
D.Fe与稀硫酸反应生成亚铁离子.
解答 解:A.硫酸铝溶液中加入过量氨水,离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+NH4+,故A错误;
B.碳酸钠溶液中加入澄清石灰水,离子方程式为:Ca2++CO32-═CaCO3↓,故B错误;
C.向NaHCO3溶液中加入少量的澄清石灰水,生成碳酸钙和碳酸钠、水,离子方程式为:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O,故C正确;
D.Fe与稀硫酸反应生成亚铁离子,离子方程式为:Fe+2H+═Fe2++H2↑,故D错误.
故选C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
18.下列关于胶体的叙述正确的是( )
| A. | 利用丁达尔效应可以区分淀粉溶胶和肥皂水 | |
| B. | 1L1 mol•L-1Fe(OH)3胶体中,胶粒数目小于NA | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| D. | Fe(OH)3胶体的电泳实验说明了胶体带有电荷 |
19.在蒸发皿中加热蒸干并灼烧(<400℃)下列物质的溶液,可以得到该物质的固体的是( )
| A. | AlCl3 | B. | MgSO4 | C. | Na2SO3 | D. | Ca(HCO3)2 |
3.某同学在实验报告中有以下实验数据:①用托盘天平称取11.7g食盐;②用量筒量取5.26 mL盐酸;③用160mL容量瓶配制160mL 1 mol/L KCl溶液,其中数据合理的是( )
| A. | ① | B. | ②③ | C. | ①③ | D. | ② |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 硝酸银与盐酸反应:AgNO3+Cl-═NO3-+AgCl↓ |
17.下列溶液中氯离子的浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )
| A. | 150mL1mol/L NaCl溶液 | B. | 75mL2mol/L NH4Cl溶液 | ||
| C. | 150mL3mol/L KCl溶液 | D. | 75mL1mol/L CuCl2溶液 |
15.已知:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:设计了如下系列实验:
(1)该实验①、②可探究温度对反应速率的影响,因此V1、V2和V3分别是10.0、10.0、0
(2)实验①、③可探究浓度对反应速率的影响,因此V4、V5分别是10.0、6.0.
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)实验①、③可探究浓度对反应速率的影响,因此V4、V5分别是10.0、6.0.


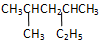 的系统命名是:2,4-二甲基己烷
的系统命名是:2,4-二甲基己烷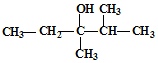 的键线式是
的键线式是
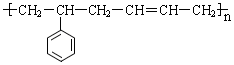 的单体结构简式为:
的单体结构简式为: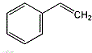 和CH2=CH-CH=CH2
和CH2=CH-CH=CH2