题目内容
7.在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-三者所占的物质的量分数(a)随溶液pH变化关系如图所示,下列叙述错误的是( )
| A. | H2R是二元弱酸,其Kal=1×10-2 | |
| B. | 当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) | |
| C. | NaHR在溶液中水解倾向大于电离倾向 | |
| D. | 含Na2R与NaHR各0.1mol的混合溶液的pH=7.2 |
分析 A、据pH=2时各离子浓度计算Ka1;
B、据电荷守恒判断;
C、NaHR溶液显酸性可知其电离程度大于其水解程度;
D、pH=7.2时,Na2R与NaHR溶液浓度相同.
解答 解:A、据图可知pH=2时,Ka1=$\frac{c({H}^{+})×c(H{R}^{-})}{c({H}_{2}R)}$=$\frac{1×1{0}^{-2}×0.5}{0.5}$=1×10-2,故A正确;
B、据电荷守恒,c(H+)+c( Na +)=2c ( R2-)+c( HR-)+c(OH-),溶液显中性时c(H+)=c(OH-),所以c( Na +)=2c ( R2-)+c( HR-),故B正确;
C、NaHR溶液显酸性可知其电离程度大于其水解程度,故C错误;
D、Na2R与NaHR溶液浓度相同时,其pH=7.2,故D正确;
故选C.
点评 本题考查了据图分析数据进行电离平衡常数的计算、电离程度与水解程度大小判断以及电荷守恒的应用,题目难度中等.

练习册系列答案
相关题目
2.关于氢键,下列说法正确的是( )
| A. | 每一个水分子内含有两个氢键 | |
| B. | 氢键只能存在于分子之间 | |
| C. | DNA中的碱基互补配对是通过氢键来实现的 | |
| D. | HF是一种非常稳定的化合物,这是由氢键所致 |
16.分子式为C5H12的化合物,共有几种不同的结构( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
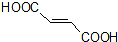 的合成路线如下:
的合成路线如下: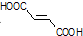
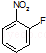 中含有的官能团名称为硝基,氟原子.
中含有的官能团名称为硝基,氟原子.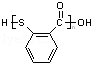 .
.