题目内容
氧化还原反应广泛地存在于生产和生活之中.下列过程中不涉及氧化还原反应的是( )
| A、金属的冶炼 | B、燃放鞭炮 |
| C、食物的腐败 | D、豆浆制豆腐 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应中存在元素的化合价变化为氧化还原反应,若不存在元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答:
解:A.金属冶炼中金属元素的化合价降低,为氧化还原反应,故A不选;
B.燃放鞭炮,为爆炸反应,属于剧烈的氧化还原反应,存在元素的化合价变化,故B不选;
C.食物腐败为食物缓慢氧化的过程,故C不选;
D.豆浆制豆腐涉及胶体的聚沉,没有发生氧化还原反应,故D选.
故选D.
B.燃放鞭炮,为爆炸反应,属于剧烈的氧化还原反应,存在元素的化合价变化,故B不选;
C.食物腐败为食物缓慢氧化的过程,故C不选;
D.豆浆制豆腐涉及胶体的聚沉,没有发生氧化还原反应,故D选.
故选D.
点评:本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从化合价角度分析,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所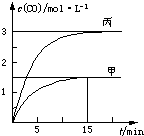 示.下列说法正确的是( )
示.下列说法正确的是( )
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所
 示.下列说法正确的是( )
示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V>0.5L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒关系错误是( )
| A、c (Na+)+c (H+)=c (X-)+c (OH-) |
| B、c (HX)+c (X-)=2 c (Na+) |
| C、若溶液显酸性,则有:c (X-)>c (Na+)>c (HX)>c (H+)>c (OH-) |
| D、若溶液显碱性,则有:c (Na+)>c (HX)>c (X-)>c (OH-)>c (H+) |
某同学在实验室中用KClO3代替MnO2制备Cl2,反应原理为KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.下列叙述不正确的是( )
| A、氧化剂为KClO3,其中Cl元素被还原 |
| B、若有3molH2O生成,则反应中有6mol电子转移 |
| C、浓HCl在反应中起酸性和还原性的作用 |
| D、氧化剂与还原剂的物质的量之比为1:5 |
下列描述中正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O的分子数为1 NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、64 g SO2中含有的氧原子数为1NA |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
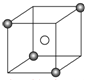 某离子晶体的晶胞结构如图所示,X(
某离子晶体的晶胞结构如图所示,X( )位于立方体的顶点,Y(○)位于立方体的中心.试分析:
)位于立方体的顶点,Y(○)位于立方体的中心.试分析: W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题: