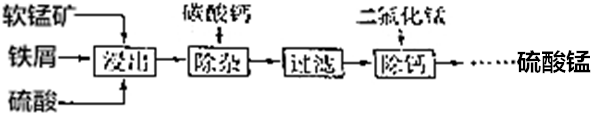
题目内容
14.用惰性电极电解含0.2molCuSO4的溶液一段时间后,阳极上生成标准状况下4.48L气体,欲使电解质溶液恢复电解前的状况,应加入( )| A. | 0.2molCuSO4 | B. | 0.2molCuO | C. | 0.2molCu(OH)2 | D. | 0.2molCuCO3 |
分析 阳极上OH-放电生成O2,n(O2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,转移电子物质的量=0.2mol×4=0.8mol,如果Cu2+完全放电转移电子物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上H+还放电生成氢气,所以实质上相当于电解得到CuO和H2O,要是溶液恢复到原状态,需要加入CuO和H2O,电解生成n(H2)=$\frac{0.8mol-0.4mol}{2}$=0.2mol,所以氢气和Cu的物质的量相等,所以析出的相当于Cu(OH)2,根据Cu原子守恒计算加入固体质量.
解答 解:阳极上OH-放电生成O2,n(O2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,转移电子物质的量=0.2mol×4=0.8mol,如果Cu2+完全放电转移电子物质的量=0.2mol×2=0.4mol<0.8mol,所以阴极上H+还放电生成氢气,所以实质上相当于电解得到CuO和H2O,要是溶液恢复到原状态,需要加入CuO和H2O,电解生成n(H2)=$\frac{0.8mol-0.4mol}{2}$=0.2mol,所以氢气和Cu的物质的量相等,所以析出的相当于0.2molCu(OH)2,故选C.
点评 本题考查电解原理,正确判断阴极上析出物质成分是解本题关键,利用转移电子守恒进行计算即可,题目难度中等.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
4.相同物质的量浓度的下列溶液,[NH4+]最大的是( )
| A. | NH4HCO3 | B. | NH4HSO4 | C. | NH4NO3 | D. | CH3COONH4 |
5.化学让生活更美好,生活中涉及化学的点点滴滴.下列叙述正确的是( )
| A. | 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 | |
| B. | 小苏打可中和胃酸,热纯碱溶液可除油污;小苏打和纯碱可以用石灰水鉴别 | |
| C. | 用丁达尔效应区别鸡蛋白溶液和食盐水 | |
| D. | “84消毒液”和洁厕剂能同时使用,除污垢效果更好 |
2.下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A. | 稀有气体、浓硫酸、胆矾 | B. | 金刚石、石灰石、铁矿石 | ||
| C. | 天然气、碱式碳酸铜、液氧 | D. | 石墨、熟石灰、水煤气 |
3.工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知:CO(g)+2H2(g)?CH3OH(g)△H=-92.9kJ/mol,一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是( )
| A. | 升高温度平衡向正反应方向移动 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 该反应的△S<0 |
4.在一定温度下,将32g Cu投入到一定体积某浓度的HNO3溶液中,Cu全部溶解,且反应后生成NO2和NO的物质的量之比为l:3,则参加反应的HNO3的物质的量为( )
| A. | 2.8 mol | B. | 2.6 mol | C. | 1.4 mol | D. | 0.8 mol |