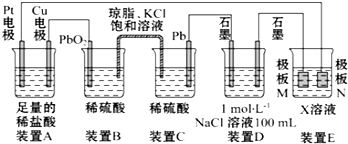
题目内容
4.在一定温度下,将32g Cu投入到一定体积某浓度的HNO3溶液中,Cu全部溶解,且反应后生成NO2和NO的物质的量之比为l:3,则参加反应的HNO3的物质的量为( )| A. | 2.8 mol | B. | 2.6 mol | C. | 1.4 mol | D. | 0.8 mol |
分析 反应中硝酸起氧化剂与酸性作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2.根据电子转移守恒计算NO2和NO的物质的量,由氮元素守恒可知参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO).
解答 解:反应中硝酸起氧化剂与酸性作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2,由Cu原子守恒可知,n[Cu(NO3)2]=n(Cu)=0.5mol,生成NO2和NO的物质的量之比为l:3,令NO2的物质的量为y mol,NO为3y mol,根据电子转移守恒,则:
0.5mol×(2-0)=y mol×(5-4)+3y mol×(5-2),解得y=0.1,
由氮元素守恒可知n(HNO3)=2n[Cu(NO3)2]+n(NO2)+n(NO)=2×0.5mol+0.1mol+0.1mol×3=1.4mol,
故选C.
点评 本题考查氧化还原反应计算,难度中等,利用电子转移守恒与元素守恒计算是关键,注意守恒思想在氧化还原反应计算中的运用.

练习册系列答案
相关题目
14.用惰性电极电解含0.2molCuSO4的溶液一段时间后,阳极上生成标准状况下4.48L气体,欲使电解质溶液恢复电解前的状况,应加入( )
| A. | 0.2molCuSO4 | B. | 0.2molCuO | C. | 0.2molCu(OH)2 | D. | 0.2molCuCO3 |
9.根据转化关系判断下列说法正确的是( )
(C6H10O5)n$\stackrel{①}{→}$葡萄糖→乙醇$→_{②}^{+乙酸}$乙酸乙酯.
(C6H10O5)n$\stackrel{①}{→}$葡萄糖→乙醇$→_{②}^{+乙酸}$乙酸乙酯.
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
16.在容积不变的密闭容器中,1molN2和1molH2在一定温度下发生反应,达到平衡时,H2的转化率为30%,则平衡时的氨气的体积分数约为( )
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
13.下列有关化学反应能量变化的叙述中正确的是( )
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应 ②只要是在点燃条件下进行的反应就一定是吸热反应 ③只要是在常温常压下进行的反应就一定是放热反应 ④燃烧反应一定是放热反应 ⑤化合反应、中和反应都是放热反应,分解反应都是吸热反应.
①如果反应物的总能量低于生成物的总能量,该反应一定是吸热反应 ②只要是在点燃条件下进行的反应就一定是吸热反应 ③只要是在常温常压下进行的反应就一定是放热反应 ④燃烧反应一定是放热反应 ⑤化合反应、中和反应都是放热反应,分解反应都是吸热反应.
| A. | ①④ | B. | ①②③ | C. | ③⑤ | D. | ④⑤ |
14.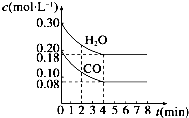 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |