题目内容
1.一定温度下,m g下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠完全反应,过氧化钠增质量加了n g,且n>m,符合此要求的物质是①H2②CO ③CO和H2的混合物 ④HCOOH ⑤CH3CHO( )| A. | ①②③ | B. | ⑤ | C. | ④ | D. | ①②③④ |
分析 由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2H2O=4NaOH+O2、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2Na2O2+2CO2=2Na2CO3+O2,可知过氧化钠增加的质量即为H2、CO的质量,因此只要是CO或H2或它们的混合气体或化学组成符合(CO)m•(H2)n时m=n,若n>m,则不符合(CO)m•(H2)n,以此来解答.
解答 解:由上述分析可知,n>m,则不符合(CO)m•(H2)n,
①②③均符合(CO)m•(H2)n,④HCOOCH3化学式改写为(CO)2•(H2)2符合(CO)m•(H2)n;
⑤CH3CHO化学式改写为(CO)2•(H2)2.C,燃烧后与足量的过氧化钠完全反应,过氧化钠增质量加了n g,且n>m,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握过氧化钠增重的实质、化学式的变形为解答的关键,侧重分析与计算能力的考查,注意过氧化钠的性质,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某卤代烷烃C5H11Cl发生消去反应时,可以得到两种烯烃,则该卤代烷烃的结构简式可能为( )
| A. | CH3CH2CH2CH2CH2Cl | B. | 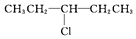 | ||
| C. | 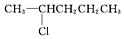 | D. | 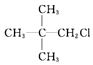 |
9.下列物质中,既能发生消去反应又能被氧化成醛的是( )
| A. | CH3OH | B. | CH3CH2CH2OH | ||
| C. |  | D. |  |
16.五种短周期主族元素A、B、C、D、E的原子序数依次增大,A2属于绿色燃料,C的氧化物用于生产光导纤维,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是( )
| A. | 五种元素中有两种金属元素 | |
| B. | 元素C、D、E的最高价氧化物对应水化物的酸性增强 | |
| C. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
6. 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
 用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列各组实验,具体操作如下:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测的实验现象 |
| A | 浓盐酸 | 二氧化锰固体 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生白色沉淀 |
| D | 稀硫酸 | 滴有石蕊的亚硫酸钠溶液 | 溶液逐渐变红 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关有机物的说法正确的是( )
| A. | 日常生活中常见的聚乙烯、聚氯乙烯、聚四氟乙烯都可以通过加聚反应得到 | |
| B. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 | |
| C. | 苯与溴水混合,反复振荡后溴水层褪色,这是由于发生了取代反应 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
10.过量的铁粉与100mL 0.1mol/L的稀盐酸反应,反应速率太快.为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的NaNO3固体 ⑤加NaCl溶液⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 1mol/L的盐酸.
| A. | ①⑥⑦ | B. | ①⑤ | C. | ③⑧ | D. | ③⑥⑧ |
11.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子与氯化铝分子互为等电子体,都是非极性分子 | |
| D. | 氯化硼的熔沸点与氯硼键的键能大小有关 |
